
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:

(1)写出上述实验过程中所用试剂:试剂①___________;试剂③___________。
(2)判断试剂①已过量的方法是:_______________________。
(3)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉__________(填“能”或“不能”)透过半透膜;SO42-___________(填“能”或“不能”)透过半透膜。
(4)操作④的名称是________________。
(5)实验室用制得的NaCl晶体配制480mL1.0mol/L的NaCl溶液,用托盘天平称量的氯化钠固体的质量是___________,配制过程用到的玻璃仪器除量筒、烧杯、胶头滴管外,还有_____________。
(6)分析以下操作对配制的溶液浓度造成的影响,影响偏高的是____________________。
①蒸馏水洗完容量瓶后没有烘干
②转移溶液过程中出现漏液
③溶解后未经冷却就转移到容量瓶
④定容时俯视
⑤摇匀后发现液面降低,再加蒸馏水
【答案】 BaCl2 HCl 静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量 不能 能 蒸发结晶 29.3g 500ml容量瓶 ③④
【解析】本题主要考查氯化钠的提纯方法。
(1)试剂①用来除去![]() ,是氯化钡溶液;试剂③用来除去
,是氯化钡溶液;试剂③用来除去![]() 、H+,是盐酸。
、H+,是盐酸。
(2)判断试剂①已过量的方法是:静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。
(3)操作①是利用半透膜进行分离提纯,胶体微粒不能透过半透膜,水分子、离子可以透过半透膜,操作①的实验结果:淀粉不能透过半透膜;SO42-能透过半透膜。
(4)氯化钠的溶解度随着温度升高变化缓慢,从溶液得到晶体需要蒸发结晶,操作④的名称是蒸发结晶。
(5)实验室用制得的NaCl晶体配制480mL1.0mol/L的NaCl溶液,需用500mL容量瓶配制溶液,用托盘天平称量的氯化钠固体的质量是1.0mol/×0.5L×58.5g/mol=29.3g,配制过程用到的玻璃仪器除量筒、烧杯、胶头滴管外,还有500mL容量瓶。
(6)①对配制的溶液浓度没有影响;②溶质损失,使配制的溶液浓度偏低;③冷却后溶液体积减小,配制的溶液浓度偏高;④溶液体积变小,配制的溶液浓度偏高;⑤溶液体积增大,配制的溶液浓度偏低。故选③④。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( ) 
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子不可能共平面
D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制城法”生产纯碱和化肥NH4Cl.工艺流程如图所示。下列有关说法不正确的是

A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 粗盐可采用除杂和重结晶等过程提纯
C. 流程图中的系列操作中用到的玻璃仪器可能有玻璃棒、烧杯、漏斗、坩埚等
D. 该流程中得到的晶体用到了溶解度的差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)给定条件下的下列四种物质:①标准状况下112mL液态水,②含有40mol质子的NH3, ③2mol的乙醇,④4g氦气,则上述物质中所含分子数目由多到少的顺序是________________(填序号)。
(2)标准状况下,0.51g某气体的体积为672mL,则该气体相对分子质量为______。
(3)将100mLH2SO4和HCl混合溶液分成两等份,一份中加入含0.2molNaOH溶液时恰好中和完全,向另一份中加入含0.05molBaCl2溶液时恰好沉淀完全,则原溶液中c(Cl-)=_________。
(4)标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液密度为ρg/mL,则所得溶液溶质物质的量浓度=________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( ) 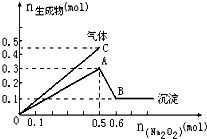
A.2:1:2
B.1:2:2
C.2:2:1
D.9:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在水溶液中或熔化状态下能导电的物质称为电解质
B.强酸、强碱和大多数盐属于强电解质
C.自由移动离子数目多,导电能力一定强
D.碱性氧化物不一定是金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是______(用字母代号填).
A.FeB.FeCl3C.FeSO4D.Fe2O3
(2)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm.
(3)检验溶液中Fe3+存在的试剂是______(填物质名称),证明Fe3+存在的现象是______.电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:______.
(4)若要验证溶液中不含Fe3+而只含有Fe2+,正确的实验操作方法及现象是______.
(5)欲从制造印刷电路板的废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
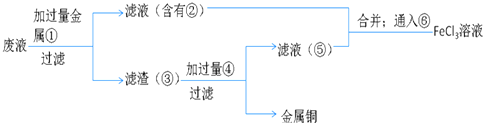
A.请写出上述实验中加入或生成的有关物质的化学式:
①______④______
B.请写出通入⑥反应的离子方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,则可以从长颈漏斗中加入的试剂是 ( )
①食盐水②KNO3溶液③适量硫酸铜溶液④Na2CO3溶液⑤CCl4 ⑥浓氨水
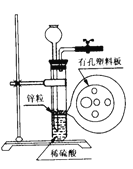
A. ①②④ B. ②⑥ C. ②③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有短周期X、Y、Z、M、W为五种短周期元素.其中X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L﹣1;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
A.原素Z,W的简单离子的电子层结构不同
B.Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性
C.由X元素形成的单质不一定是原子晶体
D.由X,YCZ,M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com