
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( ) 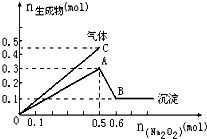
A.2:1:2
B.1:2:2
C.2:2:1
D.9:2:4
科目:高中化学 来源: 题型:
【题目】欲观察环戊烯( ![]() )是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005molL﹣1KMnO4溶液并不断振荡.下列哪一种试剂最适合用来溶解环戊烯做此实验( )
)是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005molL﹣1KMnO4溶液并不断振荡.下列哪一种试剂最适合用来溶解环戊烯做此实验( )
A.四氯化碳
B.裂化汽油
C.甲苯
D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: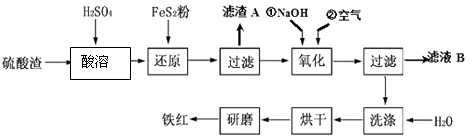
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;“滤渣A”主要成份的化学式为 .
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请完成该反应的离子方程式:FeS2+14Fe3++H2O═15Fe2++SO ![]() + .
+ .
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) .
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、(1) 4.9gH3PO4的物质的量为____,其中含有____molH,含有______个O,含磷元素___g,若它可与6gNa0H完全反应生成正盐,则H3PO4为_____元酸。
(2)在9.5g某二价金属的氯化物中含有0.2molCl-,此氯化物的摩尔质量为____, 该金属元素为______。
II、有一包白色固体,可能含有CaCO3、Na2S04、KNO3、CuSO4、BaCl2五种物质中的一种或几种,现进行如下实验:
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
(3)取少量(2)中的溶液滴加Ba(NO3)2为溶液,有白色沉淀生成,加稀硝酸沉淀不溶。
根据上述实验现象判断:该白色固休中一定含有____,一定不含有____,可能含有_____。
III、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.504gNaHCO3, 2片小苏打片和胃酸完全中和,被中和的H+是___mol。
(2)胃舒平每片含0.234gAl(OH)3。写出胃舒平中和胃酸的离子反应方程式___, 中和胃酸时,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备硅单质时,主要化学反应如下:
(1)SiO2+2C ![]() Si(粗硅)+2CO
Si(粗硅)+2CO
(2)Si(粗)+2Cl2 ![]() SiCl4
SiCl4
(3)SiCl4+2H2 ![]() Si (纯)+4HCl
Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
A.(1)(3)为置换反应
B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应
D.反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:

(1)写出上述实验过程中所用试剂:试剂①___________;试剂③___________。
(2)判断试剂①已过量的方法是:_______________________。
(3)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉__________(填“能”或“不能”)透过半透膜;SO42-___________(填“能”或“不能”)透过半透膜。
(4)操作④的名称是________________。
(5)实验室用制得的NaCl晶体配制480mL1.0mol/L的NaCl溶液,用托盘天平称量的氯化钠固体的质量是___________,配制过程用到的玻璃仪器除量筒、烧杯、胶头滴管外,还有_____________。
(6)分析以下操作对配制的溶液浓度造成的影响,影响偏高的是____________________。
①蒸馏水洗完容量瓶后没有烘干
②转移溶液过程中出现漏液
③溶解后未经冷却就转移到容量瓶
④定容时俯视
⑤摇匀后发现液面降低,再加蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列所示实验装置制取乙酸乙酯.回答以下问题: 
(1)在大试管中先加入3mL , 然后一边摇动一边慢慢地加入2mL和2mL乙酸,混合均匀,然后加入几粒碎瓷片.按上图连好装置,用酒精灯对大试管小心均匀加热.当观察到明显现象时停止实验.
(2)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中.在此处球形干燥管的作用除了使乙酸乙醋充分冷凝外还有;
(3)有甲、乙、丙三位同学,分别将乙酸与乙醉反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来.但他们的结果却不同: ①甲得到了不溶于水的中性酯;②乙得到显酸性的酯的混合物;③丙得到大量水溶性物质.
试判断三位同学加入的NaOH是多了还是怡好还是少了(填“少量”、“适量”、“过量“)
①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):++═+
(2)整个过程中的还原剂是
(3)把KI换成KBr,则CCl4层变为色:继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 .
(4)加碘盐中含碘量为20mg~50mg/kg.制取加碘盐(含KIO3的食盐)1000kg,若庄Kl与Cl2反应制KIO3 , 至少需要消耗Cl2L(标准状况,保留2位小数).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com