
����Ŀ��I����1�� 4.9gH3PO4�����ʵ���Ϊ____�����к���____molH������______��O������Ԫ��___g����������6gNa0H��ȫ��Ӧ�������Σ���H3PO4Ϊ_____Ԫ�ᡣ
��2����9.5gij���۽������Ȼ����к���0.2molCl-�����Ȼ����Ħ������Ϊ____, �ý���Ԫ��Ϊ______��
II����һ����ɫ���壬���ܺ���CaCO3��Na2S04��KNO3��CuSO4��BaCl2���������е�һ�ֻ��֣��ֽ�������ʵ�飺
��1��ȡ���������ĩ�ӵ�����ˮ�У��õ���ɫ�������ϲ�Ϊ��ɫ��Һ��
��2�����������м�������ϡ���ᣬ��ɫ������ȫ��ʧ���������ݲ�����
��3��ȡ������2���е���Һ�μ�Ba��NO3��2Ϊ��Һ���а�ɫ�������ɣ���ϡ����������ܡ�
��������ʵ�������жϣ��ð�ɫ������һ������____��һ��������____�����ܺ���_____��
III��С�մ�θ��ƽ����ϲ���dz��õ��к�θ���ҩ�
��1��С�մ�ƬÿƬ��0.504gNaHCO3, 2ƬС�մ�Ƭ��θ����ȫ�кͣ����к͵�H+��___mol��
��2��θ��ƽÿƬ��0.234gAl��OH��3��д��θ��ƽ�к�θ������ӷ�Ӧ����ʽ___, �к�θ��ʱ��6ƬС�մ�Ƭ�൱��θ��ƽ_____Ƭ��
��3����ϲ�Ļ�ѧ�ɷ�������þ�ļ�ʽ�Ρ�ȡ�ü�ʽ��3.01g������2.0mol/L����ʹ���ܽ⣬����������42.5mLʱ����ʼ����CO2������������45.0mLʱ���÷�Ӧ��ȫ����ü�ʽ����Ʒ����������̼��������ʵ���֮��Ϊ_____��
���𰸡�0.05mol0.151.204��10231.55g��95g/molMgCaCO3��Na2SO4CuSO4��BaCl2KNO30.012Al(OH)3+3H+=Al3++3H2O416��1
��������
I����1)n(H3PO4)=![]() ��n(H)=0.05mol��3=0.15mol��N��O��=0.05mol��4��6.02��1023=1.204��1023��m(P)=0.05mol��31g/mol=1.55g ��6gNa0HΪn(NaOH)=
��n(H)=0.05mol��3=0.15mol��N��O��=0.05mol��4��6.02��1023=1.204��1023��m(P)=0.05mol��31g/mol=1.55g ��6gNa0HΪn(NaOH)=![]() ��0.15mol��0.05mol=3��1������Ϊ��Ԫ�
��0.15mol��0.05mol=3��1������Ϊ��Ԫ�
(2��M=![]() ���û������к������ȣ����������ԭ������Ϊ95-31.5��2=24��Ϊ����þ��
���û������к������ȣ����������ԭ������Ϊ95-31.5��2=24��Ϊ����þ��
II����1��ȡ���������ĩ�ӵ�����ˮ�У��õ���ɫ�������ϲ�Ϊ��ɫ��Һ��һ������CuSO4������CaCO3����BaCl2��Na2SO4�����е�һ�������
��2�����������м�������ϡ���ᣬ��ɫ������ȫ��ʧ���������CaCO3��һ����CaCO3��
��3��ȡ������2���е���Һ�μ�Ba��NO3��2��Һ���а�ɫ�������ɣ��ټ���ϡ���ᣬ�������ܣ����������ᱵ��һ������Na2SO4��һ������BaCl2�����Ϸ�����֪��һ������CaCO3��Na2SO4��һ��������CuSO4��BaCl2�����ܺ���KNO3
III��(1��n(H)=n(HCO3�D)=2��0.504g/84g��mol-1=0.012 mol
��2��������Ӧ�� Al(OH)3+3H+=Al3++3H2O��6ƬС�մ�Ƭ���к�θ�6��0.504g/84g��mol-1=0.036mol��1Ƭθ��ƽ���к�θ�3��0.234g/78g��mol-1=0.009mol��6ƬС�մ�Ƭ�൱��θ��ƽ4Ƭ��
��3������������42.5mLǰ����OH��+H����H2O��CO32��+H������HCO3��������������42.5mL����HCO3��+H��=H2O+CO2������֪�������������ʵ�����42.5��0.001L��2mol��L-1��(45-42.5)��0.001L��2mol��L-1=0.08mol��̼��������ʵ���Ϊ��(45-42.5)��0.001L��2mol��L-1=0.005mol����ֵ16:1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʳƷ���Ӽ��У���ʹ��Ŀ���뷴Ӧ�����йص��ǣ� ��
A.������B.��ζ��C.��ɫ��D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����ƺ��д������и����ӵ���Һ��������ʵ�ֵ��ǣ� ��
A. Fe2+��NH4+�� Cl-��OH-B. K+�� H+��SO42-�� OH-
C. Na+�� Fe2+��Fe3+��NO3-D. K+��HCO3-�� MnO4-�� H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ô��Σ���Ca2+��Mg2+��SO42-�����ʣ�Ϊ��Ҫԭ�ϲ����������ƳǷ�����������ͻ���NH4Cl������������ͼ��ʾ�������й�˵������ȷ����

A. �Դ�����Һ���ӿ����μ���NaOH��Na2CO3��BaCl2���ټ������������ҺpH
B. ���οɲ��ó��Ӻ��ؽᾧ�ȹ����ᴿ
C. ����ͼ�е�ϵ�в������õ��IJ������������в��������ձ���©����������
D. �������еõ��ľ����õ����ܽ�ȵIJ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�dz������ʼ��ת����ϵ�����мס��ҡ�����Ϊ�ǽ������ʣ�A��B��E�Ͷ���Ϊ�����B��EΪ�ܲ�������ЧӦ��������1mol E�к��� 10mol���ӣ��ҺͶ�Ϊ��ɫ���壬�����ǻ�ͼ��Ⱥ��ֹ����ɺ�ɫ��Ϊ��ɫ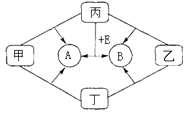
��1��д����ѧʽ��������������
��2������Ħ������Ϊ ��
��3��д������E��Ӧ����A��B�Ļ�ѧ����ʽ��
��4����ѧ�����ҺͶ���ͼ��Ⱥ��ռ�����״��������8.96L����ø����������������ܶ�Ϊ16����������ͨ�������ij���ʯ��ˮ�У��õ���ɫ������g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������µ������������ʣ��ٱ�״����112mLҺ̬ˮ���ں���40mol���ӵ�NH3�� ��2mol���Ҵ�����4g����������������������������Ŀ�ɶൽ�ٵ�˳����________________������ţ���
��2����״���£�0.51gij��������Ϊ672mL�����������Է�������Ϊ______��
��3����100mLH2SO4��HCl�����Һ�ֳ����ȷݣ�һ���м��뺬0.2molNaOH��Һʱǡ���к���ȫ������һ���м��뺬0.05molBaCl2��Һʱǡ�ó�����ȫ����ԭ��Һ��c(Cl-)=_________��
��4����״���£�VL�����ܽ���1Lˮ�У�ˮ���ܶȽ���Ϊ1g/mL����������Һ�ܶ�Ϊ��g/mL����������Һ�������ʵ���Ũ��=________________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Mg2+��NH4+��Al3+�����Һ�м���Na2O2���������ɳ�������������������꣩�Ĺ�ϵ��ͼ��ʾ������Һ���������ӵ����ʵ���֮��Ϊ�� �� 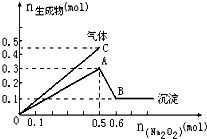
A.2��1��2
B.1��2��2
C.2��2��1
D.9��2��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʹ�õĽ���֮һ�����������仯�����֪ʶ������������⣮
��1��������Ԫ�ؼ������������л�ԭ�Ե�������______������ĸ�������
A��FeB��FeCl3C��FeSO4D��Fe2O3
��2�����ˮ����εμ�1mol/LFeCl3��Һ����Һ������ĺ��ɫ���÷�ɢϵ������ֱ���ķ�Χ��______nm��
��3��������Һ��Fe3+���ڵ��Լ���______�����������ƣ���֤��Fe3+���ڵ�������______�����ӹ�ҵ��Ҫ��30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�壬��д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ��______��
��4����Ҫ��֤��Һ�в���Fe3+��ֻ����Fe2+����ȷ��ʵ�����������������______��
��5����������ӡˢ��·��ķ�ˮ�л���ͭ�������»��FeCl3��Һ���ʵ�鷽�����£�
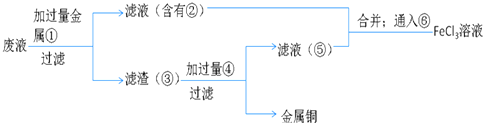
A����д������ʵ���м�������ɵ��й����ʵĻ�ѧʽ��
��______��______
B����д��ͨ���Ӧ�����ӷ���ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ���������Ϊa%�����ʵ���Ũ��Ϊc1mol/L��ϡ�������������һ������ˮ��ʹ��������Ϊ2a%����ʱ��������ʵ���Ũ��Ϊc2 mol/L����֪����Ũ��Խ���ܶ�Խ����c1 ��c2����ֵ��ϵ�ǣ� ��
A.c1=2c2
B.c2=2cl
C.c2��2c1
D.c2��2cl
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com