
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | 8.2×107 | K1 | … |
| [C]2 |
| [A]?[B]3 |
| [C]2 |
| [A]?[B]3 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:


| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③①④ | B、③②①④ |
| C、③①②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6% | B、7.7% |
| C、15.6% | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 aA、bB、cC、dD四种短周期元素,它们的原子序数有如下关系:c-b=b-a=1 且 b+c=d,B的最高价氧化物对应水化物为强酸.
aA、bB、cC、dD四种短周期元素,它们的原子序数有如下关系:c-b=b-a=1 且 b+c=d,B的最高价氧化物对应水化物为强酸.查看答案和解析>>
科目:高中化学 来源: 题型:
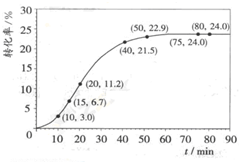 甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l);△H>0
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l);△H>0| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol?min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀释100倍后,两溶液的pH相同 |
| B、加入NaOH固体恰好中和后,两溶液的pH相同 |
| C、加入足量的小苏打固体充分反应后,两溶液中产生的CO2一样多 |
| D、分别加入足量的锌粉充分反应,反应开始时两酸产生H2的反应速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com