
【题目】常温下,用0.100molL-1NaOH溶液分别滴定20.00mL浓度均0.100molL-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是( )
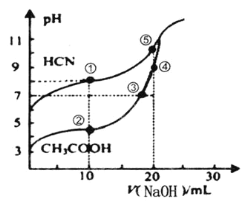
A.点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B.点③时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点③和点④所示溶液中水的电离程度:③<④
D.点④溶液中阴离子总数小于点⑤
【答案】D
【解析】
根据图像初始pH可知,浓度为0.100molL-1CH3COOH溶液和HCN溶液均为弱酸,且HCN的酸性比弱酸小,电离程度小;酸或碱抑制水的电离,盐促进水的电离,根据三大守恒关系回答问题。
A. 点①的溶液中存在电荷守恒为c(OH-)+c(CN-)=c(Na+)+c(H+),而且c(OH-)>c(H+),点②所示溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),而且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),A正确;
B. 点③电荷守恒关系,c(OH-)+c(CH3COO-)=c(Na+)+c(H+),根据pH=7可知,c(Na+)=c(CH3COO-)>c(H+)=c(OH-),B正确;
C. 点③溶液中含有醋酸钠和醋酸,点④溶液中只含有醋酸钠,酸抑制水的电离,盐促进水的电离,所示溶液中水的电离程度:③<④,C正确;
D. 点④溶液为醋酸钠,点⑤溶液为NaCN,故电荷守恒可知,阴离子浓度总数=c(H+)+c(Na+),由图可知,点④溶液氢离子浓度大,故点④溶液中阴离子总数大于点⑤,D错误。
答案为D。


科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月科学家在Science杂志首次报道了具有半导体特性的18个原子纯碳环分子(如图所示)。下列说法不正确的是
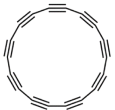
A.该分子属于有机物
B.该分子可能要比苯更加活泼
C.该分子所有的碳的杂化方式都是sp
D.该分子具有半导体的功能,可以使类似的直碳链成为分子级电子元件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是

A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e=2Cl+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为 4:3,Z 原子比 X 原子的核外电子数多 4。下列说法正确的是
A.W、Y、Z 的电负性大小顺序一定是 Z>Y>W
B.W、X、Y、Z 的原子半径大小顺序可能是 W>X>Y>Z
C.Y、Z 形成的分子空间构型可能是正四面体
D.WY2 分子中![]() 键与π键的数目之比是 2:1
键与π键的数目之比是 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见无机物A、B、C、D存在如图转化关系:
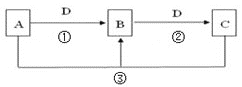
(1)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一![]() 遇空气会变色,则反应
遇空气会变色,则反应![]() 的化学方程式为_________________________________________________。
的化学方程式为_________________________________________________。
(2)若A为常见挥发性强酸,D是生产生活中用量最大用途最广的金属单质,则B的化学式是_____________________。
(3)若A、C、D都是常见气体,C是形成酸雨的主要气体,则A的电子式是____________。
(4)若A、B、C的水溶液均显碱性,焰色反应均为黄色,D为![]() ,举出C的一种用途_______________________。
,举出C的一种用途_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为,![]() ,放电工作示意图如图。下列叙述不正确的是
,放电工作示意图如图。下列叙述不正确的是
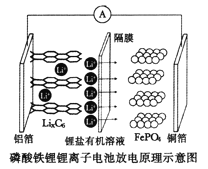
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:![]()
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示实验合理的是( )
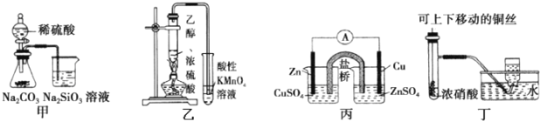
A.图甲证明非金属性强弱:S>C>Si
B.装置乙可用于检验有乙烯生成
C.图丙构成铜锌原电池,产生持续稳定的电流
D.图丁可制备并收集NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
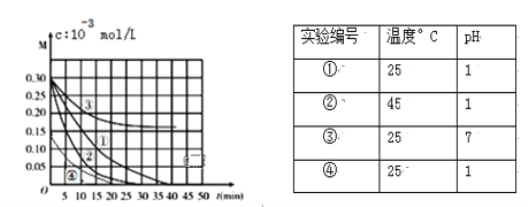
下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com