
Ⅰ 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布图是_________________。
(2)C、N、O 三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H 键断裂,则形成的π 键有________mol。
Ⅱ 金属镍在电池、合金、催化剂等方面应用广泛。
(4)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______。
(5)甲醛(H2C=O)在Ni 催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C 原子的杂化方式为________。
Ⅲ 氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(6)写出N2H62+与碱溶液反应的离子方程式 ;
(7)写出N3-等电子体物质的化学式 ;(一种)
(18分)
(1)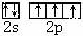 (2分) (2)N>O>C (2分)
(2分) (2)N>O>C (2分)
(3)①三角锥形(2分) sp3(2分) ②3(2分)
(4)C (2分) (5)sp2 (2分)
(6)N2H62++2OH-=N2H4+2H2O (2分) (7)N2O CO2 CNO- 等 (2分)
【解析】
试题分析:Ⅰ(1)根据构造原理可知,基态氮原子的价电子排布图是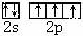 。
。
(2)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能大于氧元素的,则C、N、O三种元素第一电离能从大到小的顺序是N>O>C。
(3)①氨气分子中中心原子氮原子含有1对孤对电子,所以NH3分子的空间构型是三角锥型,NH3中氮原子轨道的杂化类型是sp3。而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。
②反应中有4mol N-H键断裂,即有1molN2H4参加反应,生成1.5molN2,则形成的π键有3mol。
Ⅱ(4)Ni含有2对未成对电子,所以第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳元素。
(5)甲醛是平面型结构,所以中心原子碳原子的杂化方式是sp2杂化。
Ⅲ(6)N2H62+与碱溶液反应类似于NH4+与碱液的反应,所以反应的方程式是N2H62++2OH-=N2H4+2H2O。
(7)原子数和价电子数分别都相等的是等电子体,则和N3-等电子体物质的化学式是N2O、CO2 、CNO- 等。
考点:考查核外电子排布式、轨道表达式、杂化轨道类型、分子空间结构、等电子体以及化学键的有关计算和判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和知识的迁移能力。该题以“周期表中的元素”为载体,考查学生对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)该电中性的分子X的化学式是___________,电子式是_________。
(2)一个![]() 具有_____________个电子。
具有_____________个电子。
(3)写出两种由多原子组成的含有与![]() 电子数相同的微粒的化学式____________。
电子数相同的微粒的化学式____________。
(4)用电子式描述![]() 形成的过程。
形成的过程。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省射阳中学高二上学期期末考试化学(选修)试卷 题型:填空题
碳是形成化合物种类最多的元素,氮元素可以形成多种化合物,氧是地壳中含量最多的元素。
回答以下问题:(12分,每空2分)
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 (填化学式)的排放量.
(2)基态氮原子的价电子排布式是_________ ________。
(3)氧元素基态原子核外未成对电子数为 个。
(4)C、N、O三种元素第一电离能从大到小的顺序是____________。
(5)若某元素E的原子最外层电子排布为2s22 p1,某元素F的原子外围电子排布为2s22p2,则元素E与元素F的电负性从大到小顺序是_____ _______(用元素符号表示)。
元素F在元素周期表 区域(填s、p、d、ds、f区)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com