
【题目】人工模拟光合作用,设计的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从a极向b极迁移
C. 该转化过程中,水得到电子
D. 该装置中发生的总反应为6CO2+8H2O![]() 2C3H8O+9O2
2C3H8O+9O2
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
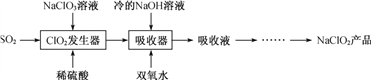
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-![]() 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I-![]() 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-![]() Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是

A. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
B. a点由水电离出的c(H+)=1.0![]() mol/L
mol/L
C. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
D. c点:c(Cl-)=c(NH![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。
(2)硒、砷、溴三种元素的第一电离能从大到小的顺序为___________(用元素符号表示)。
(3)两种三角锥形气态氢化物PH3和NH3的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_____________________________________________________________。
(4)常温下PCl5是白色晶体,在148℃时熔化成能导电的熔体。该熔体由A、B两种微粒构成,A、B分别与CCl4、SF6互为等电子体,则A的化学式为__________________,其中心原子杂化方式为_______________。
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为ρg·cm-3),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。


①与Au距离最近的Cu个数为________。
②该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为__________,则晶胞中Cu原子与Au原子中心的最短距离d=________cm。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为__________(![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
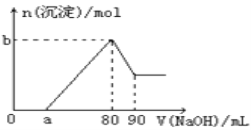
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态N2O4是火箭推进系统的有效氧化剂。实验室制备少量N2O4的流程如下:
![]()
下列分析正确的是
A. 反应①、③中氮元素的化合价发生了变化
B. 反应②利用了NH3的氧化性
C. 反应④的颜色变化是由化学平衡移动引起的
D. 反应①可由图所示装置实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或实验操作不正确的是
A. 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中
B. 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出
C. NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热
D. 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知用含硫酸铁的废液(含少量杂质)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:

回答下列问题:
①试剂X是_______,写出发生的主要反应的离子方程式___________。
②操作Ⅱ的名称为:________、_________。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/LKMnO4溶液滴定,测得消耗KMnO4溶液的平均体积为22.00mL。
滴定终点的现象为: _______________________;该晶体中铁的质量分数为___________。(保留4位有效数字)
(2)某课题组通过实验检验摩尔盐晶体加热时的分解产物。
①摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O b.FeO、NH3、SO3、H2O
c.FeO、SO2、NH3、H2Od.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想___________不成立(填序号)。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有_____________;C装置中红色褪去,说明气体产物中含有__________;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是__________(写一种即可)。

③丙同学想利用上述装置证明分解产物中含有氨气。只需更换B、C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为摩尔盐分解可能会生成N2和SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com