
����Ŀ��ij��ѧʵ��С���Ե�Ʒ���(Cr2O3��CuO��Fe2O3��CaO)Ϊԭ����ȡͭ�ۺ�K2Cr2O7����Ҫ������ͼ��
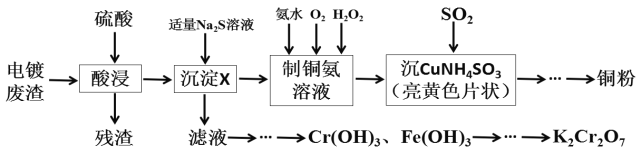
��1����������Na2S��Һ�����ɵij���XΪ___���������Na2S��Һ������������X��ᷢ����Ӧ�����ӷ���ʽΪ___��
��2������ƽ[Cu(NH3)4]SO4��H2O���ȷ����ֽⷴӦ�Ļ�ѧ����ʽ��
___[Cu(NH3)4]SO4��H2O![]() ___Cu+___NH3��+___SO2��+___N2��+___H2O
___Cu+___NH3��+___SO2��+___N2��+___H2O
��3������CuNH4SO3��ʱ������ͼװ��(�г֡�����������)��
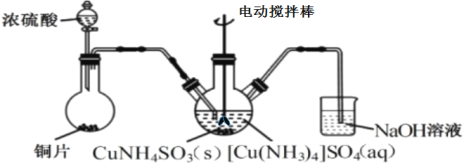
������CuNH4SO3��ʱ����Ӧ�¶��������45�棬���ʵļ��ȷ�ʽ��___��
��NaOH��Һ��������___��
��4���ⶨ��Ʒ��K2Cr2O7�����ķ������£���ȡ��Ʒ����2.0g���250mL��Һ��ȡ��25.00mL����ƿ�У���������ϡ�����ữ���ټ��뼸��ָʾ������0.1000mol/L���������(NH4)2Fe(SO4)2��Һ���еζ����ظ���������ʵ�顣(��֪Cr2O72-����ԭΪCr3+)
��������ʵ������(NH4)2Fe(SO4)2��Һ��ƽ�����Ϊ20.00mL�������ò�ƷK2Cr2O7�Ĵ���Ϊ___%��
������������K2Cr2O7����������ԭ��Ӧ��������Һ�г�����Cr3+��������һ��Ũ�ȵ�Fe3+����ͨ����pH�ķ���ʹ����ת��Ϊ�����������������ӳ�ʼŨ�Ⱦ�Ϊ2��10-3mo/L������Һ�иտ�ʼ����Cr(OH)3����ʱ��c(Fe3+)=___mo/L��{��֪��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31}
���𰸡�CuS 2Fe3++3S2-=2FeS��+S����2Fe3++S2-=2Fe2++S�� 3 3 8 3 2 9 ˮԡ���� ����SO2��ֹ��Ⱦ���� 49 1.3��10-10
��������
����Ʒ���(Cr2O3��CuO��Fe2O3��CaO)�м���ϡ�����ܽⷢ����Ӧ�õ�Cr2(SO4)3��CuSO4��Fe2(SO4)3��CaSO4��Ȼ��ˮ�������˳�ȥ����CaSO4���ڽ���Һ�м���Na2S������Һ��pH��ֻʹCuSO4����������Ӧ��������CuS���ڳ�ֽ����¼��백ˮ������H2O2����ͨ��O2, ��Ӧ������[Cu(NH3)4]SO4������SO2�Ļ�ԭ�Խ��仹ԭ������CuNH4SO3����Һ������ҺpHʹ���ӳ������������Ϊ�ظ���ء�
��1����������Na2S��Һ�����ɵij���XΪCuS���������Na2S��Һ������������X��ᷢ����Ӧ�����ӷ���ʽΪ2Fe3++3S2-=2FeS��+S����2Fe3++S2-=2Fe2++S����
��2������������ԭ��Ӧԭ����ԭ���غ��֪��[Cu(NH3)4]SO4��H2O���ȷ����ֽⷴӦ�Ļ�ѧ����ʽ3[Cu(NH3)4]SO4��H2O![]() 3Cu+8NH3��+3SO2��+2N2��+9H2O��
3Cu+8NH3��+3SO2��+2N2��+9H2O��
��3��������CuNH4SO3��ʱ����Ӧ�¶��������45�棬�����Ⱦ��ȣ����ʵļ��ȷ�ʽ��ˮԡ���ȡ�
�ڶ��������ж���NaOH��Һλ��װ��β����Ŀ����β������������������SO2��ֹ��Ⱦ������
��4����Cr2O72-Ϊ����������Fe2+����ΪFe3+��+6�۸�����ԭΪ+3����Ӧ�����ӷ���ΪCr2O72-+6 Fe2++14H+=2 Cr3++6 Fe3++7H2O��������ʵ������(NH4)2Fe(SO4)2��Һ��ƽ�����Ϊ20.00mL�������ò�ƷK2Cr2O7�Ĵ���Ϊ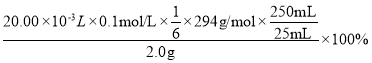 =49%��
=49%��
�ڼ������ӳ�ʼŨ��Ϊ2��10-3mo/L������Һ�иտ�ʼ����Cr(OH)3����ʱ�� ![]() ����c(Fe3+)=
����c(Fe3+)=![]() 1.3��10-10mo/L��
1.3��10-10mo/L��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������������Ӧʱ����������Ũ�ȵ��½��ͽ�����Ե��������е�Ԫ�صĻ��ϼۻ����½������ǿ�����![]() ��NO��
��NO��![]() ��
��![]() ��
��![]() �е�һ�ֻ��֡�ijͬѧȡһ�����������Ͻ���һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���
�е�һ�ֻ��֡�ijͬѧȡһ�����������Ͻ���һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���![]() ��Һ������NaOH��Һ�������������������ʵ����Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
��Һ������NaOH��Һ�������������������ʵ����Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
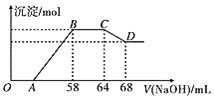
![]() д���Ͻ��������ϡ���ᷴӦ�����ӷ���ʽ��___________��
д���Ͻ��������ϡ���ᷴӦ�����ӷ���ʽ��___________��
![]() �Ͻ����������ʵ���Ϊ__________mol���������ʵ���Ϊ__________mol��
�Ͻ����������ʵ���Ϊ__________mol���������ʵ���Ϊ__________mol��
![]() ���Ӧ�ij��������ʵ���Ϊ__________mol��
���Ӧ�ij��������ʵ���Ϊ__________mol��
![]() ���Ӧ������������Һ�����Ϊ__________mL��
���Ӧ������������Һ�����Ϊ__________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ں�������Ԫ������![]() ���ı���Ʒ�Ѿ������г�����֪������ͬ�壬���ͬ���ڣ������й���������������ȷ���ǣ� ��
���ı���Ʒ�Ѿ������г�����֪������ͬ�壬���ͬ���ڣ������й���������������ȷ���ǣ� ��
A.�������ڳ������ǹ���
B.������̬�⻯���ȶ��Ա�![]() ǿ
ǿ
C.���ǽ���Ԫ��
D.���ᣨ![]() �������Ա�����ǿ
�������Ա�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������NH3����Ρ�N2H4��N2O4������ѧ��ѧ��������ҵ������������ռ����Ҫ��λ��
(1)���亽����������(N2H4)��N2O4��ȼ������ȼ������(N2H4)��N2O4�ķ�ӦΪ
2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) ��H=-1077 kJ��mol-1��
��֪��ط�Ӧ�Ļ�ѧ�������������±���ʾ��
��ѧ�� | N��H | N��N |
| O��H |
E/(kJ��mol��1) | 390 | 190 | 946 | 460 |
��ʹ1 mol N2O4(g)�����л�ѧ����ȫ����ʱ��Ҫ���յ�������________________��
��������˵��2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) ��H ��ƽ��״̬����________
a.��������ƽ����Է����������� b.V��N2��=3V�� N2O4��
c.N2H4���������ֲ��� d. ��H���ٱ仯
(2)N2O4��NO2֮����ڷ�ӦN2O4(g) ![]() 2NO2(g)����һ������N2O4���˺����ܱ������У������ƽ��ת����[��(N2O4)]���¶ȵı仯����ͼ��ʾ��
2NO2(g)����һ������N2O4���˺����ܱ������У������ƽ��ת����[��(N2O4)]���¶ȵı仯����ͼ��ʾ��

����ͼ�Ʋ�÷�Ӧ�ġ�H_______0(��>����<��)������Ϊ____________________________��
��ͼ��a���Ӧ�¶��£���֪N2O4����ʼѹǿp0Ϊ108 kPa������¶��·�Ӧ��ƽ�ⳣ��Kp��________________ (��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
(3)���NO2�Ʊ�NH4NO3���乤��ԭ������ͼ��ʾ��

�������ĵ缫��ӦʽΪ____________________________________________________��
��Ϊʹ������ȫ��ת��ΪNH4NO3���貹��ij�ֻ����������A����A�Ļ�ѧʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�ҹ����¹ڷ����߹�����ȡ���˽���ʤ�������������人������4��8����ʱ��⡣�ڹ�����������ίԱ�ᷢ���ġ�����״�����������Ʒ��������е����棩���У���������������ҩ��������������ୡ�������������������һ���������Ƶá����(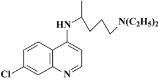 )��������·�ߺϳɣ�
)��������·�ߺϳɣ�
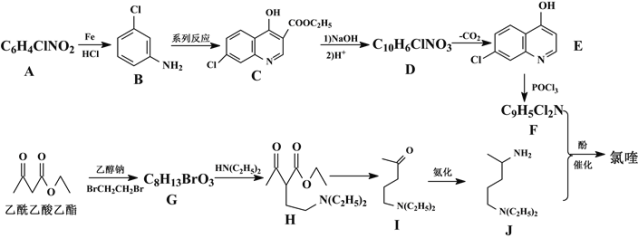
�ش��������⣺
��1��A������Ϊ___��G�к��������ŵ�����Ϊ___��G��H�ķ�Ӧ����Ϊ___��
��2��д��F+J����୵Ļ�ѧ��Ӧ����ʽ___��
��3���л���B������H2�ӳɺ�IJ���ΪX��������*�����X�е�����̼ԭ��___��
��4��M��H��Ϊͬ���칹�壬��������������M��___�֡����к˴Ź�����������ʾ��7�����շ壬�������Ϊ6��4��4��4��3��1��1����ṹ��ʽΪ___ (��дһ��)��
�ٺ�����Ԫ���ͣ�N(C2H5)2������������ˮ����ﺬ������ܷ���������Ӧ
��5���������Ϻϳ�·�ߣ��������1��3������ϩ�ͱ�Ϊԭ�Ϻϳ�![]() �ĺϳ�·��___��
�ĺϳ�·��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����;�㷺�ľ�ϸ������Ʒ����ҵ�������������ķ����ܶ࣬��ͼ��

����˵����ȷ����
A. ��Ӧ�١��ھ���ȡ����Ӧ
B. ��Ӧ�ۡ��ܵ�ԭ�������ʾ�Ϊ100��
C. ������������Ϊͬ���칹������������2��
D. �Ҵ������ᡢ��������������ɫҺ�����Na2CO3��Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ʒ�ˮ��ʹ��NaCN��������0.5 mg/L�����ɴﵽ�ŷű�����Ӧ���������С���һ��NaCN��NaClO��Ӧ������NaOCN��NaCl���ڶ���NaOCN��NaClO��Ӧ������Na2CO3��CO2��NaCl��N2����֪HCN�����ᣬ�ӷ����о綾��HCN��HOCN��NԪ�صĻ��ϼ���ͬ������˵����ȷ����
A. ����NaCN�����Ʒ�ˮ�Ĺ�������Ԫ�ػ��ϼ۵ĸı�
B. ��һ����Ӧ��ҺӦ����Ϊ���ԣ��ɱ��������ж�����HCN
C. �ڶ��������ķ�ӦΪ2OCN�� + 3ClO�� ![]() 2CO2�� + CO32 + 3Cl�� + N2��
2CO2�� + CO32 + 3Cl�� + N2��
D. ����100 m3��NaCN 10.3 mg/L�ķ�ˮʵ��������Ҫ50 mol NaClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����Ħ����������������Ҫ���࣬�ھ�ˮ�Ͷ��������ȷ��������Ҫ���á�
��1����FeCl3��Һ��ʴӡˢ��·���ϵ�ͭ����������Һ�м������ۣ��Լ������۳�ַ�Ӧ�����Һ������������__________��
a��������ʣ�࣬����Һ��һ����Fe3�� b�����й�����ڣ�����Һ��һ����Fe2��
c������Һ����Cu2������һ��û�й������� d������Һ����Fe2������һ����Cu����
��2����ҵ��ͨ����������FeCl2��Һ�õ���FeCl3����Һ��������FeCl2��Һ��c(Fe2+)=2.0��10��2mol��L��1��c(Fe3+)=1.0��10��3mol��L��1�� c(Cl��)=5.3��10��2mol��L��1�������Һ��pHԼΪ____��������ˮ�ĵ�������ӵ�ˮ�⣩��
��3��Ħ����[(NH4)2Fe(SO4)2��6H2O]�ڶ��������г���Ϊ�����ʣ������궨�ظ���ء�������ص���Һ��Ũ�ȣ���0.1mol��L��1 �ĸ��ε���Һ�У�����Ũ���ɴ�С��˳����____
��4����ƽ���ӷ���ʽ��___Fe2+ +___ MnO4�� +____ H+ �� ___Mn2+ +____Fe3+ +___ H2O
��5����֪Ħ������Է�������ΪM=392��ȡĦ���β�Ʒ23.520g�����ʲ��������ط�Ӧ�������250mL��Һ��ȡ��25mL��0.0500mol��L��1 KMnO4��Һ�ζ�������KMnO4��Һ19.50mL�����Ʒ��Ī���ε���������Ϊ__________����С����ʾ��������λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A�������ʵ�����O2��CO2������ԭ������Ϊ2NA
B����״���£�2.24 Lһ�ȼ����к�����ԭ����ĿΪ0.3NA
C���ڷ�ӦKIO3+6HI��KI+3I2+3H2O�У�ÿ����3mol I2ת�Ƶĵ�����Ϊ6NA
D��6.8 g���ڵ�KHSO4�к���0.1 NA��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com