
【题目】氯化铁和摩尔盐是铁的两种重要盐类,在净水和定量分析等方面具有重要作用。
(1)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是__________。
a.若无固体剩余,则溶液中一定有Fe3+ b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则一定没有固体析出 d.若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为____(不考虑水的电离和离子的水解)。
(3)摩尔盐[(NH4)2Fe(SO4)2·6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在0.1mol·L-1 的该盐的溶液中,离子浓度由大到小的顺序是____
(4)配平离子方程式:___Fe2+ +___ MnO4- +____ H+ → ___Mn2+ +____Fe3+ +___ H2O
(5)已知摩尔盐相对分子质量为M=392,取摩尔盐产品23.520g(杂质不与高锰酸钾反应),配成250mL溶液,取出25mL用0.0500mol·L-1 KMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数为__________(用小数表示,保留四位小数)。
【答案】b 2 SO42->NH4+>Fe2+>H+>OH- 5 1 8 1 5 4 0.8125
【解析】
(1)FeCl3溶液腐蚀印刷电路版上的铜,发生的离子反应为2Fe3++ Cu= 2Fe2++Cu2+,氧化性顺序为Fe3+> Cu2+> Fe2+,所得的溶液中加入铁粉,可能发生反应Fe+ Cu2+= Cu +Fe2+,Fe +2Fe3+=3Fe2+。
a.若无固体剩余,当铁粉刚好与Fe3+恰好完全反应,溶液不存在Fe3+,故a错误;
b.无论铁粉的量如何,只要发生反应,溶液中就一定存在Fe2+,故b正确;
c.若溶液中有Cu2+,说明铁粉不足,可能有固体析出,故c错误;
d. 因为氧化性顺序为Fe3+> Cu2+,加入少量铁粉,溶液中一定存在Fe2+,不一定有Cu析出,故d错误;
综上所述,本题正确答案为b。
(2)根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,可以忽略不计,则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2molL-1,则溶液pH=-lg1.0×10-2=2。所以答案为:2。
(3)摩尔盐[(NH4)2Fe(SO4)2·6H2O]溶解形成的溶液中存在铵根离子、亚铁离子、硫酸根离子,铵根离子、亚铁离子水解显酸性,最大的是硫酸根离子,其次是铵根离子浓度、亚铁离子浓度、氢离子浓度和氢氧根离子浓度,离子浓度大小为: c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);所以答案:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)。
(4)先根据得失电子相等,配平氧化剂和还原剂及其产物,分别是1 MnO4-被还原为1 Mn2+,5 Fe2+被氧化为5Fe3+;再根据电荷守恒或者氧、氢原子守恒即可得到:8 H+ ,4 H2O ,所以配平离子方程式的系数分别为5、1、 8、1、 5、 4 ;所以答案为 5、1、 8、1、 5、 4。
(5)消耗的高锰酸钾的物质的量为:0.0500mol/L×0.0195L=9.75×10-4mol,250mL溶液中需要消耗的高锰酸钾的物质的量为:9.75×10-4mol×![]() =9.75×10-3mol,根据反应5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O,亚铁离子的物质的量为:n(Fe2+)=5n(MnO4-)=5×9.75×10-3mol=4.875×10-2mol,莫尔盐产品23.520g中含有的莫尔盐质量为:392g/mol×4.875×10-2mol=19.11g,产品中莫尔盐的质量分数为:
=9.75×10-3mol,根据反应5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O,亚铁离子的物质的量为:n(Fe2+)=5n(MnO4-)=5×9.75×10-3mol=4.875×10-2mol,莫尔盐产品23.520g中含有的莫尔盐质量为:392g/mol×4.875×10-2mol=19.11g,产品中莫尔盐的质量分数为:![]() =0.813;故答案为:81.3%。
=0.813;故答案为:81.3%。


科目:高中化学 来源: 题型:
【题目】把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是
A.NaOH溶液B.CH3COOHC.稀HNO3D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7。主要流程如图:
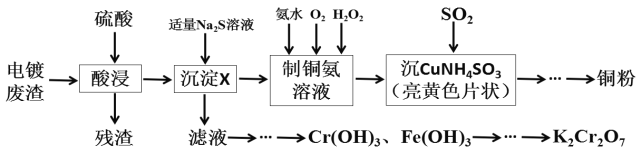
(1)加入适量Na2S溶液后生成的沉淀X为___,若加入的Na2S溶液过量,除生成X外还会发生反应的离子方程式为___。
(2)请配平[Cu(NH3)4]SO4·H2O加热发生分解反应的化学方程式。
___[Cu(NH3)4]SO4·H2O![]() ___Cu+___NH3↑+___SO2↑+___N2↑+___H2O
___Cu+___NH3↑+___SO2↑+___N2↑+___H2O
(3)“沉CuNH4SO3”时可用如图装置(夹持、加热仪器略):
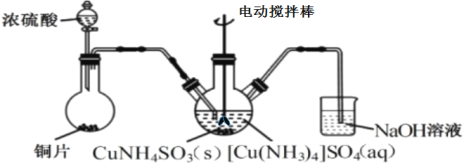
①“沉CuNH4SO3”时,反应温度需控制在45℃,合适的加热方式是___。
②NaOH溶液的作用是___。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.0g配成250mL溶液,取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol/L硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行三次实验。(已知Cr2O72-被还原为Cr3+)
①若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为20.00mL,则所得产品K2Cr2O7的纯度为___%。
②上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+,还含有一定浓度的Fe3+,可通过调pH的方法使两者转化为沉淀。假设两种离子初始浓度均为2×10-3mo/L,当溶液中刚开始析出Cr(OH)3沉淀时,c(Fe3+)=___mo/L。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3(aq)与KSCN(aq)混合时存在下列平衡: Fe3+(aq)+SCN-(aq) Fe(SCN)2+(aq)。已知平衡时,c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
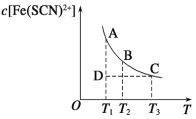
A.FeCl3(aq)与KSCN(aq)的反应是放热反应
B.T1、T2时反应的平衡常数分别为K1、K2,则K1<K2
C.反应处于D点时,一定有υ正<υ逆
D.恒温下加入KCl固体,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O=H++OH-,下列叙述正确的是( )
A.![]() 表示的粒子不会对水的电离平衡产生影响
表示的粒子不会对水的电离平衡产生影响
B.![]() 表示的物质加入水中,促进水的电离,c(H+)增大
表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时,CH3COO-加入水中,促进水的电离,Kw不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]和铵明矾[NH4Al(SO4)2·12H2O]都是限制使用的食品添加剂。
(1)KAl(SO4)2的电离方程式为_______________ KAl(SO4)2可作净水剂,其原因是(用必要的化学用语和相关文字说明)。
(2)已知几种电解质溶液的 pH随温度变化的曲线如图1所示。 其中符合KAl(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字)。
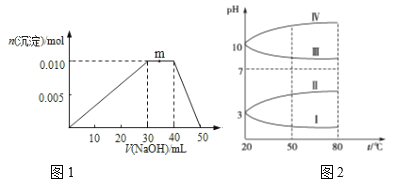
(3)向盛有100mL NH4Al(SO4)2溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意如图2所示。
①写出m点反应的离子方程___
②当加入45mL NaOH时,烧杯中Al元素的存在形式为 __________
③由图象可知所滴NaOH溶液的浓度为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,N表示粒子数。下列叙述正确的是( )
A. 在标准状况下2.24LCCl4中含有的C—Cl键数为0.4NA
B. 将1mol Cl2通入水中,则N(HClO)+N(Cl)+N(ClO)=2NA
C. 将CO2通过Na2O2使其质量增加a g时,反应转移的电子数为aNA/14
D. 3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.铁粉溶于足量稀硝酸3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O
B.三氯化铁溶液中滴入硫氯酸钾溶液出现血红色Fe3++3SCN—=Fe(SCN)3
C.饱和氯化铁溶液滴入沸水溶液呈现红褐色Fe3++3H2O=Fe(OH)3↓+3H+
D.四羟基合铝酸钠溶液与碳酸氢钠溶液混合产生白色沉淀 [Al(OH)4]—+ HCO3—=Al(OH)3↓+CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com