
【题目】下列离子方程式能用来解释相应实验现象的是
A.铁粉溶于足量稀硝酸3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O
B.三氯化铁溶液中滴入硫氯酸钾溶液出现血红色Fe3++3SCN—=Fe(SCN)3
C.饱和氯化铁溶液滴入沸水溶液呈现红褐色Fe3++3H2O=Fe(OH)3↓+3H+
D.四羟基合铝酸钠溶液与碳酸氢钠溶液混合产生白色沉淀 [Al(OH)4]—+ HCO3—=Al(OH)3↓+CO2↑+H2O
科目:高中化学 来源: 题型:
【题目】氯化铁和摩尔盐是铁的两种重要盐类,在净水和定量分析等方面具有重要作用。
(1)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是__________。
a.若无固体剩余,则溶液中一定有Fe3+ b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则一定没有固体析出 d.若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为____(不考虑水的电离和离子的水解)。
(3)摩尔盐[(NH4)2Fe(SO4)2·6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在0.1mol·L-1 的该盐的溶液中,离子浓度由大到小的顺序是____
(4)配平离子方程式:___Fe2+ +___ MnO4- +____ H+ → ___Mn2+ +____Fe3+ +___ H2O
(5)已知摩尔盐相对分子质量为M=392,取摩尔盐产品23.520g(杂质不与高锰酸钾反应),配成250mL溶液,取出25mL用0.0500mol·L-1 KMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数为__________(用小数表示,保留四位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.等物质的量的O2和CO2所含氧原子数均为2NA
B.标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA
D.6.8 g熔融的KHSO4中含有0.1 NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得:

下列说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 1mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
D. 可以用FeCl3溶液鉴别乙醛酸和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 和NaCl混合溶液中,
和NaCl混合溶液中,![]() 的物质的量浓度是
的物质的量浓度是![]() 的物质的量浓度的
的物质的量浓度的![]() 倍,下列叙述中正确的是
倍,下列叙述中正确的是![]()
A.溶液中一定有![]() 和3molNaCl
和3molNaCl
B.所带电荷数![]() 是
是![]() 的
的![]() 倍
倍
C.![]() 与
与![]() 的物质的量之和等于
的物质的量之和等于![]() 的物质的量
的物质的量
D.![]() 和NaCl的物质的量之比为1:3
和NaCl的物质的量之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是![]()
A.![]() 个
个![]() 胶体粒子的质量为78g
胶体粒子的质量为78g
B.![]() g
g![]() 和CuO的混合物中含有铜原子数为
和CuO的混合物中含有铜原子数为![]()
C.在![]() 的碳酸钠溶液中,阴离子总数一定大于
的碳酸钠溶液中,阴离子总数一定大于![]()
D.标准状况下,![]() L己烷中共价键数目为
L己烷中共价键数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中一定能大量共存的是( )
①![]() 的溶液:
的溶液:![]()
②![]() 的溶液中:
的溶液中:![]()
③水电离的![]() 浓度
浓度![]() 的溶液中:
的溶液中:![]()
④加入![]() 能放出
能放出![]() 的溶液中:
的溶液中:![]()
⑤使石蕊变红的溶液中:![]()
⑥中性溶液中:![]()
A.②④B.只有②C.②④⑥D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
实验目的:制取乙酸乙酯
实验原理:甲、乙、丙三位同学均采用乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸的作用是___、___。
装置设计:甲、乙、丙三位同学分别设计了如图所示三套实验装置:

请从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,应选择的装置是___(填“Ⅰ”或“Ⅱ”)。丙同学将Ⅰ装置中的玻璃导管改成了球形干燥管,除起冷凝作用外,另一重要作用是___。
实验步骤:(1)按选择的装置组装仪器,在试管①中先加入3mL乙醇和2mL冰醋酸,并在摇动下缓缓加入2mL浓硫酸,加入2~3块碎瓷片;
(2)将试管固定在铁架上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
问题讨论:a.步骤(1)中组装好实验装置,加入样品前还应检查___。
b.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有___。
c.试管②中饱和Na2CO3溶液的作用是___、___、___。
d.从试管②中分离出乙酸乙酯的实验操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示:下列说法不正确的是( )
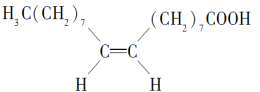
A.油酸的分子式为C18H34O2
B.油酸可与氢氧化钠溶液发生中和反应
C.1 mol油酸可与2 mol H2发生加成反应
D.1 mol甘油可与3 mol油酸发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com