
【题目】室温下,下列各组离子在指定溶液中一定能大量共存的是( )
①![]() 的溶液:
的溶液:![]()
②![]() 的溶液中:
的溶液中:![]()
③水电离的![]() 浓度
浓度![]() 的溶液中:
的溶液中:![]()
④加入![]() 能放出
能放出![]() 的溶液中:
的溶液中:![]()
⑤使石蕊变红的溶液中:![]()
⑥中性溶液中:![]()
A.②④B.只有②C.②④⑥D.①②⑥
【答案】A
【解析】
①pH=0的溶液呈酸性,I-、NO3-在酸性条件下发生氧化还原反应而不能大量共存,故①错误;
②pH=12的溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故②正确;
③水电离的H+浓度为10-12molL-1的溶液呈酸性或碱性,酸性条件下,CO32-、SO32-不能大量共存,碱性条件下NH4+不能大量存在,故③错误;
④加入Mg能放出H2的溶液呈酸性,这几种离子之间不反应且和氢离子不反应,所以能大量共存,故④正确;
⑤使石蕊变红的溶液呈酸性,酸性条件下,Fe2+和MnO4-、NO3-发生氧化还原反应而不能大量共存,故⑤错误;
⑥中性溶液中Fe3+水解生成氢氧化铁使溶液呈酸性而不能大量共存,故⑥错误;
②④正确,故答案为A。


科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]和铵明矾[NH4Al(SO4)2·12H2O]都是限制使用的食品添加剂。
(1)KAl(SO4)2的电离方程式为_______________ KAl(SO4)2可作净水剂,其原因是(用必要的化学用语和相关文字说明)。
(2)已知几种电解质溶液的 pH随温度变化的曲线如图1所示。 其中符合KAl(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字)。
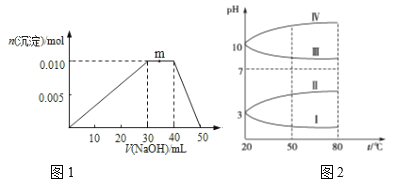
(3)向盛有100mL NH4Al(SO4)2溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意如图2所示。
①写出m点反应的离子方程___
②当加入45mL NaOH时,烧杯中Al元素的存在形式为 __________
③由图象可知所滴NaOH溶液的浓度为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 的NaOH溶液中逐滴加入某浓度的
的NaOH溶液中逐滴加入某浓度的![]() 溶液。滴定过程中,溶液的pH与滴入
溶液。滴定过程中,溶液的pH与滴入![]() 溶液的体积关系如图所示,点
溶液的体积关系如图所示,点![]() 时NaOH溶液恰好被中和。则下列说法中,正确的是
时NaOH溶液恰好被中和。则下列说法中,正确的是![]()
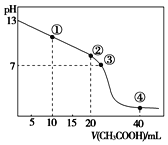
A.![]() 溶液的
溶液的![]()
B.图中点![]() 到点
到点![]() 所示溶液中,水的电离程度增大
所示溶液中,水的电离程度增大
C.点![]() 所示溶液中存在:
所示溶液中存在:![]()
D.滴定过程中会存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.铁粉溶于足量稀硝酸3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O
B.三氯化铁溶液中滴入硫氯酸钾溶液出现血红色Fe3++3SCN—=Fe(SCN)3
C.饱和氯化铁溶液滴入沸水溶液呈现红褐色Fe3++3H2O=Fe(OH)3↓+3H+
D.四羟基合铝酸钠溶液与碳酸氢钠溶液混合产生白色沉淀 [Al(OH)4]—+ HCO3—=Al(OH)3↓+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构简式如图所示,下列有关脱落酸的说法正确的是( )
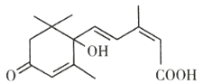
A.脱落酸的分子式为C15H18O4
B.脱落酸只能和醇发生酯化反应
C.1mol脱落酸最多可以和2mol金属钠发生反应
D.脱落酸不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果汁发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是一种常见的有机酸,其结构简式为![]() 。
。
(1)苹果酸的分子式为___。
(2)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(3)苹果酸可能发生的反应是___(填序号)。
A.与NaOH溶液反应
B.与石蕊试液作用
C.与乙酸在一定条件下发生酯化反应
D.与乙醇在一定条件下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是( )
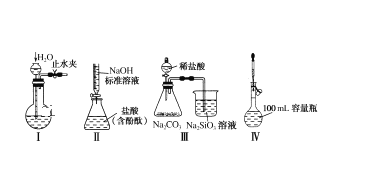
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:测定未知盐酸的浓度
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
![]() 联氨
联氨![]() 常温下为液态,在空气中迅速完全燃烧生成
常温下为液态,在空气中迅速完全燃烧生成![]() ,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知:![]() 的燃烧热为
的燃烧热为![]()
![]() ;
;![]()
![]() ;
;![]()
则![]() 在空气中燃烧生成气态水的热化学方程式为______。
在空气中燃烧生成气态水的热化学方程式为______。
![]() 工业上利用氨气生产氢氰酸
工业上利用氨气生产氢氰酸![]() 的反应为
的反应为![]()
![]() 。
。
![]() 一定温度下,向2L恒容容器中充入1mol
一定温度下,向2L恒容容器中充入1mol![]() 和2mol
和2mol![]() 发生上述反应,8min达到平衡时,测得
发生上述反应,8min达到平衡时,测得![]() 的转化率为
的转化率为![]() ,
,![]() 内,用
内,用![]() 表示的该反应速率v
表示的该反应速率v![]() ______。
______。
保持温度和容积不变,再向平衡后的容器中充入![]()
![]() 和
和![]() HCN,此时
HCN,此时![]() ______
______![]() 选填“
选填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 在
在![]() 下,将a
下,将a![]() 的NaCN溶液与
的NaCN溶液与![]() 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液![]() ,则a______
,则a______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;用含a的代数式表示HCN的电离常数
;用含a的代数式表示HCN的电离常数![]() ______。
______。
![]() 能够和
能够和![]() 形成
形成![]() 。
。
![]() 溶液中存在
溶液中存在![]()
![]()
![]()
![]()
![]() 时,其平衡常数的表达式为
时,其平衡常数的表达式为![]() ______。
______。
![]() 高剂量的亚硝酸盐有很大毒性,电化学降解
高剂量的亚硝酸盐有很大毒性,电化学降解![]() 的原理如图:
的原理如图:
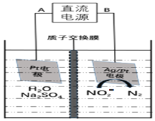
![]() 阴极反应式为______。
阴极反应式为______。
![]() 若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差
若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差![]() 为______g。
为______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com