
【题目】25℃时,水的电离达到平衡:H2O=H++OH-,下列叙述正确的是( )
A.![]() 表示的粒子不会对水的电离平衡产生影响
表示的粒子不会对水的电离平衡产生影响
B.![]() 表示的物质加入水中,促进水的电离,c(H+)增大
表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时,CH3COO-加入水中,促进水的电离,Kw不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】请解答下列与蛋白质有关的题目:
(1)鸡蛋腐烂时,常闻到有臭鸡蛋气味的气体,该气体中主要含有___________________(填化学式),说明蛋白质中含有___________________(填元素名称)元素。
(2)误食重金属盐会中毒,这是因为___________________。
(3)浓硝酸溅在皮肤上,使皮肤呈现___________________色,这是由于浓硝酸和蛋白质发生了___________________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国的新冠肺炎防疫工作已取得了阶段性胜利,疫情中心武汉市已于4月8日零时解封。在国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》中,抗病毒治疗试用药物增加了磷酸氯喹。磷酸氯喹可由氯喹和磷酸在一定条件下制得。氯喹(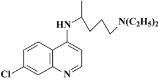 )可由以下路线合成:
)可由以下路线合成:
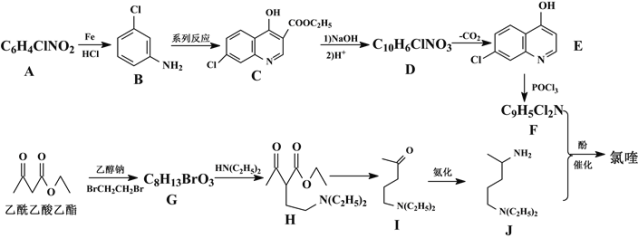
回答下列问题:
(1)A的名称为___,G中含氧官能团的名称为___,G→H的反应类型为___。
(2)写出F+J→氯喹的化学反应方程式___。
(3)有机物B与足量H2加成后的产物为X,试用“*”标出X中的手性碳原子___。
(4)M与H互为同分异构体,符合下列条件的M有___种。其中核磁共振氢谱中显示有7个吸收峰,峰面积比为6:4:4:4:3:1:1,其结构简式为___ (任写一种)。
①含有六元环和-N(C2H5)2②酸性条件下水解产物含乙酸③能发生酯化反应
(5)参照以上合成路线,请设计以1,3-丁二烯和苯为原料合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
A. 处理NaCN超标电镀废水的过程中无元素化合价的改变
B. 第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C. 第二步发生的反应为2OCN- + 3ClO- ![]() 2CO2↑ + CO32 + 3Cl- + N2↑
2CO2↑ + CO32 + 3Cl- + N2↑
D. 处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗常数,下列说法正确的是
代表阿伏加德罗常数,下列说法正确的是 ![]()
![]()
A.![]() 中,生成
中,生成![]() 标准状况
标准状况![]() 转移电子数为
转移电子数为![]()
B.56gFe与一定量的稀硝酸反应,转移电子数可能为![]()
C.足量的![]() 与一定量的浓盐酸反应得到
与一定量的浓盐酸反应得到![]() ,若向反应后的溶液中加入足量的
,若向反应后的溶液中加入足量的![]() ,则生成AgCl的物质的量为2mol
,则生成AgCl的物质的量为2mol
D.标准状况下,![]() 和
和![]() 混合后,原子总数小于
混合后,原子总数小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和摩尔盐是铁的两种重要盐类,在净水和定量分析等方面具有重要作用。
(1)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是__________。
a.若无固体剩余,则溶液中一定有Fe3+ b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则一定没有固体析出 d.若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为____(不考虑水的电离和离子的水解)。
(3)摩尔盐[(NH4)2Fe(SO4)2·6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在0.1mol·L-1 的该盐的溶液中,离子浓度由大到小的顺序是____
(4)配平离子方程式:___Fe2+ +___ MnO4- +____ H+ → ___Mn2+ +____Fe3+ +___ H2O
(5)已知摩尔盐相对分子质量为M=392,取摩尔盐产品23.520g(杂质不与高锰酸钾反应),配成250mL溶液,取出25mL用0.0500mol·L-1 KMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数为__________(用小数表示,保留四位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.氯碱工业中完全电解含2 mol NaCl的溶液产生H2分子数为NA
B.14 g分子式为CnH2n的烃中含有的碳碳双键数为NA/n
C.2.0 g H218O与2.0 g D2O中所含的中子数均为NA
D.常温下,将56 g铁片投入到足量的浓硫酸中生成SO2的分子数为1. 5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B.醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2![]() Cu2++2CH3COO-+2H2O
Cu2++2CH3COO-+2H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O![]() 2C6H5OH+CO32-
2C6H5OH+CO32-
D.甲酸溶液与足量的银氨溶液共热:HCOOH+4[Ag(NH3)2]++4OH-![]() CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 和NaCl混合溶液中,
和NaCl混合溶液中,![]() 的物质的量浓度是
的物质的量浓度是![]() 的物质的量浓度的
的物质的量浓度的![]() 倍,下列叙述中正确的是
倍,下列叙述中正确的是![]()
A.溶液中一定有![]() 和3molNaCl
和3molNaCl
B.所带电荷数![]() 是
是![]() 的
的![]() 倍
倍
C.![]() 与
与![]() 的物质的量之和等于
的物质的量之和等于![]() 的物质的量
的物质的量
D.![]() 和NaCl的物质的量之比为1:3
和NaCl的物质的量之比为1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com