
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx、挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=_____;
CO2(g)+2H2O(g)+N2(g) △H=_____;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
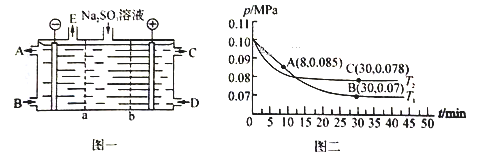
① b表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示______________。
②阳极的电极反应式为______________________________________。
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为vA(逆)_____ v0(正) (填“>” “<”或“ = ”)。
【答案】 -875.3 阴 NaOH溶液 SO32--2e-+H2O=2H++SO42- 60% <
【解析】分析:(1).根据盖斯定律,①-②-③×2得所求热化学方程式的△H;(2). ①.从C为硫酸可知,b为阴离子交换膜、a为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,则A为氢氧化钠、E为氢气;②.阳极为亚硫酸根离子放电生成硫酸根离子;(3). ①.利用三段式法,依据图中A点时气体压强为0.085,根据开始和A点时气体压强之比列式计算,转化率=![]() ×100%;②.先拐先平温度高,温度越高反应速率越大,达到平衡所需时间短。
×100%;②.先拐先平温度高,温度越高反应速率越大,达到平衡所需时间短。
详解:(1).已知①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1,根据盖斯定律,①-②-③×2得CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=-875.3 kJ·mol-1,故答案为:-875.3;
CO2(g)+2H2O(g)+N2(g) △H=-875.3 kJ·mol-1,故答案为:-875.3;
(2). ①.从C为硫酸可知,硫酸根离子来自于亚硫酸根离子放电,故b为阴离子交换膜、a为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,则A为氢氧化钠,E为氢气,故答案为:阴;NaOH溶液;
②.阳极为亚硫酸根离子放电生成硫酸根离子,电极反应式为SO32--2e-+H2O=2H++SO42-,故答案为:SO32--2e-+H2O=2H++SO42-;
(3). ①.设起始时氧气的物质的量为amol,A点时氧气消耗xmol,根据三段式法有:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始量(mol) a a 0
转化量(mol) 2x x 2x
A点量(mol) a-2x a-x 2x
图中A点时,气体的总压强为0.085,则![]() =
= ![]() ,解得x=0.3a,则SO2的转化率为
,解得x=0.3a,则SO2的转化率为![]() ×100%=60%,故答案为:60%;
×100%=60%,故答案为:60%;
②.根据图象可知,先拐先平温度高,则T1<T2,C点是平衡状态,A点反应未达到平衡状态,因温度越高反应速率越快,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为vA(逆)<v0(正),故答案为:<。


科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
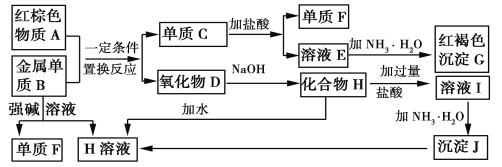
请回答下列问题:
(1)物质A的化学式为__________。
(2)写出单质B与强碱溶液反应的离子方程式____________________________。
(3)溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式___________。
(4)溶液E敞口放置容易变质,为了防止溶液E的变质,可往溶液中加入___________。
(5)溶液I中所含金属离子是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0。改变下列条件,能加快反应速率,且CO的物质的量分数增大的是
CO(g)+Cl2(g) ΔH>0。改变下列条件,能加快反应速率,且CO的物质的量分数增大的是
A. 恒容下通入He B. 恒容下增大COCl2的浓度
C. 加催化剂 D. 升温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将0.5 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为_______________。又已知:H2O(g)=H2O(l) ΔH2=-44.0 kJ·mol-1,则4.48 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________。
(2)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体。已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/ (kJ·mol-1) | 348 | 413 | 436 | 358 | 1 072 | 458 |
则工业制备甲醇的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是大气污染物的主要成分。防止空气污染,保卫“深圳蓝”是深圳市一项重要民生工程。利用下图所示装置(电极均为惰性电极)可以吸收SO2还可以用阴极排出的溶液吸收NO2。下列说法不正确的是
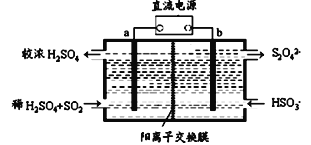
A. 电极a应连接电源的正极
B. 电极b上的电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
C. 反应过程中,H+从b极室流向a极室
D. 每吸收标况下22.4L SO2,在b极室生成NA个S2O42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实能用同一原理解释的是
A. 乙烯能使Br2水和KMnO4溶液褪色
B. 二氧化硫、氯气都会使品红溶液褪色
C. 浓硫酸和浓盐酸长期暴露在空气中浓度降低
D. 常温下,铁片和铝片放入浓硫酸中都能出现钝化现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学使人们的生活越来越美好,下列过程没有涉及化学反应的是
A. 用四氯化碳萃取碘水中的碘B. 用氯化铁溶液刻制印刷电路
C. 用漂白粉漂白纸张D. 用油脂和氢氧化钠溶液制取肥皂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com