
【题目】下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
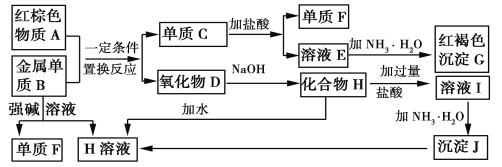
请回答下列问题:
(1)物质A的化学式为__________。
(2)写出单质B与强碱溶液反应的离子方程式____________________________。
(3)溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式___________。
(4)溶液E敞口放置容易变质,为了防止溶液E的变质,可往溶液中加入___________。
(5)溶液I中所含金属离子是____________。
【答案】Fe2O3 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 铁粉 Na+、Al3+
【解析】
红棕色A为Fe2O3,金属单质B能与强碱溶液反应,生成气体F,说明B为Al,F为H2,H为NaAlO2,溶液E中加氨水有红褐色沉淀生成,G为Fe(OH)3,A和B发生的是铝热反应,生成C为Fe,D为Al2O3,E为FeCl2。
(1)根据分析可知,物质A的化学式为Fe2O3,故答案为:Fe2O3。
(2)单质B与强碱溶液反应的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,故答案为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。
(3)溶液E(FeCl2)中加入氨水时,先生成白色沉淀L[Fe(OH)2],L最终变为红褐色沉淀G[ Fe(OH)3],化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)溶液E敞口放置容易变质,为了防止溶液E的变质,可往溶液中加入铁粉,2Fe3++Fe=3Fe2+,故答案为:铁粉。
(5)NaAlO2中加过量盐酸,离子方程式为:AlO2-+4H+= Al3++2H2O,故溶液I中所含金属离子是Na+、Al3+,故答案为:Na+、Al3+。


科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为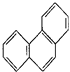 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
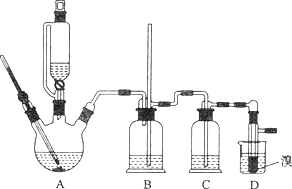
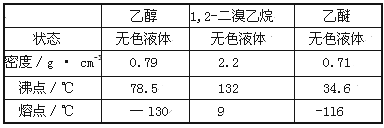
有关数据列表如下:
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式:________、_________。
(2)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________(填正确选项前的字母,下同)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是______________(填实验现象)。
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层。
(6)若产物中有少量副产物乙醚,可用_______________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是____________;但又不能过度冷却(如用冰水),其原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )
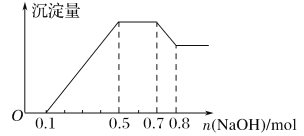
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中n(NH4+)=0.2mol
C. 溶液中一定不含CO32-,可能含有SO42-和NO3-
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是( )
A.Fe3+>Cl2>I2B.Cl2>I2>Fe3+C.I2>Cl2>Fe3+D.Cl2>Fe3+>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
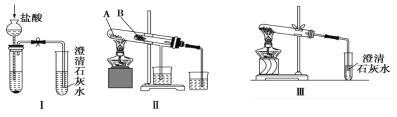
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是_______________________________。
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为__________。
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )。
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B.浓硫酸与单质硫反应的化学方程式为:S+2H2SO4(浓) ![]() 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
C.把足量铜粉投入到只含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D.常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今将Fe16.8g加入到1L浓度为nmol/L的稀硝酸溶液中(假定硝酸还原产物只NO)充分反应后,Fe和HNO3均无剩余,n不可能为
A. 0.6B. 0.8C. 1.0D. 1.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx、挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=_____;
CO2(g)+2H2O(g)+N2(g) △H=_____;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
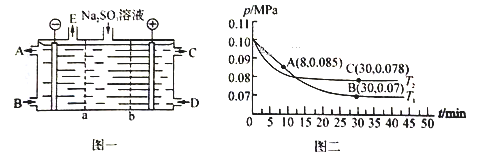
① b表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示______________。
②阳极的电极反应式为______________________________________。
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为vA(逆)_____ v0(正) (填“>” “<”或“ = ”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com