
【题目】对于反应COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0。改变下列条件,能加快反应速率,且CO的物质的量分数增大的是
CO(g)+Cl2(g) ΔH>0。改变下列条件,能加快反应速率,且CO的物质的量分数增大的是
A. 恒容下通入He B. 恒容下增大COCl2的浓度
C. 加催化剂 D. 升温
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )
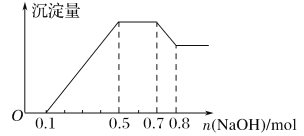
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中n(NH4+)=0.2mol
C. 溶液中一定不含CO32-,可能含有SO42-和NO3-
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今将Fe16.8g加入到1L浓度为nmol/L的稀硝酸溶液中(假定硝酸还原产物只NO)充分反应后,Fe和HNO3均无剩余,n不可能为
A. 0.6B. 0.8C. 1.0D. 1.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用如下的方法从海水中提碘:
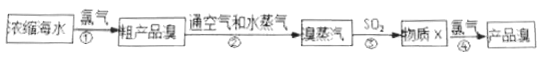
完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_________;
氯气分子中所含的化学键名称是:_________;在![]() 原子钟,其核外存在_________种运动状态不同的电子。
原子钟,其核外存在_________种运动状态不同的电子。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:_________,
两者气态氢化物的稳定性是:_________>_________(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______________(文字简述)。
(4)写出步骤③中反应的化学方程式(说明:此反应在水溶液中进行):________________;在该反应中被氧化的元素是:_________。
(5)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:_________和_________(写化学式)。
(6)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为溴化钠、溴酸钠,同时放出二氧化碳,请写出该反应的化学方程式并标明电子转移方向与数目:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知四种短周期元素A、B、C、D的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别是同一主族的元素,B、D两元素原子的质子数之和是A、C两元素原子的质子数之和的二倍。请回答下列问题。
(1)由A、B两种元素可形成E、F两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_________________________,反应物的电子式是_________,其所含化学键为(选代码)___________。
a.离子键 b.极性共价键 c.非极性共价键
(2)以上四种元素中的部分元素之间形成的化合物,能使品红溶液褪色的物质有_______________(填化学式)。
(3)由A、B、C、D四种元素组成的化合物甲和乙,它们水溶液相互反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如下图,其中只有Z为金属元素。下列说法不正确的是( )
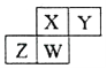
A. 原子半径W>Y
B. X的最简单气态氢化物的热稳定性比W的小
C. Z元素的氧化物既能与强酸反应又能与强碱反应
D. Y的氢化物能与其最高价含氧酸反应生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx、挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=_____;
CO2(g)+2H2O(g)+N2(g) △H=_____;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
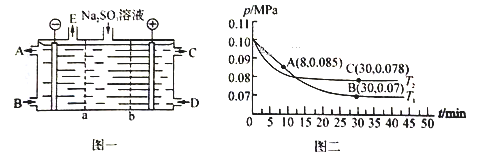
① b表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示______________。
②阳极的电极反应式为______________________________________。
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为vA(逆)_____ v0(正) (填“>” “<”或“ = ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)或-1g[c(H+)/c(HC2O4-)]和-1gc(C2O42-)关系如图所示,下列说法不正确的是
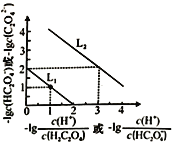
A. 曲线L1表示-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)的关系
B. Ka2(H2C2O4)的数量级为10-2
C. 已知 NaHC2O4溶液的pH<7,则溶液中c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
D. 向0.1mol/L H2C2O4溶液中加入少量水[c(HC2O4-)/c(H2C2O4)]增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
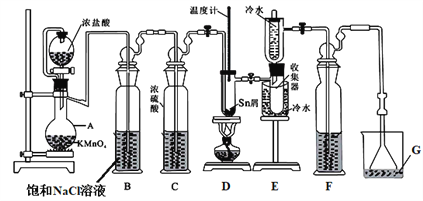
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______________。
(2)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是_____________________________________。
(3)设置试剂F的目的是_______________。
(4)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用c mol·L-1 碘单质标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量______(用含c、m、V的代数式表示)。
(5)某实验小组甲欲证明由A装置产生的气体中确实含有HCl,设计了如下实验装置。
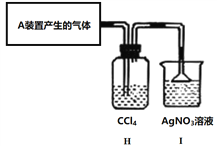
乙小组认为,不能确定进入I装置的气体只有一种。经过充分讨论,乙小组认为可以在不改动装置的前提下,仅替换一种试剂,即可完成论证。请给出改动方案:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com