
下列说法正确的是
A.增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大
B. 升高温度,使活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的分子间的碰撞均为有效碰撞
D. 加入反应物,使活化分子百分数增加,化学反应速率一定增大
科目:高中化学 来源: 题型:
金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组在实验室中探究Ti、Mg、Cu的活动性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象如下:
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡 速率缓慢 | 放出气泡 速率快 | 无变化 |
下列有关三种金属的说法正确的是( )。
A.三种金属的活动性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和MgCl2溶液不发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是

A.调节pH可以改变反应的方向 B.pH = 0.68时,反应处于平衡状态
C. pH = 5时,负极电极反应式为2I--2e- =I2 D. pH = 0.68时,氧化性I2〉AsO43-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下, 2SO2+O2 2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
A. 大于45.3% B. 小于45.3% C. 等于45.3% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
关于右图所示装置(盐桥含KCl)的叙述,正确的是
A.铜离子在铜片表面被氧化
B.铜作阳极,铜片上有气泡产生
C.电流从锌片经导线流向铜片
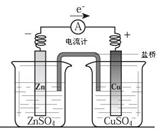 D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多
D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应: 2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为:
(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的叙述中不正确的是
A.布朗运动是胶体微粒特有的运动方式,只用肉眼就可以把胶体和溶液、浊液区别开来
B.向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀
C.丁达尔效应是胶体的特性
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中氯元素被其他元素氧化的是
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.MnO2+4HCl MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各溶液pH最小的是
A.pH=0的溶液 B.0.04 mol·L-1 H2SO4
C.0.5 mol·L-1 HCl D.0.05 mol·L-1CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com