
下列关于胶体的叙述中不正确的是
A.布朗运动是胶体微粒特有的运动方式,只用肉眼就可以把胶体和溶液、浊液区别开来
B.向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀
C.丁达尔效应是胶体的特性
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
下列叙述中正确的是( )。
A.含金属元素的离子,不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
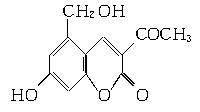 2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式
___________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与3 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大
B. 升高温度,使活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的分子间的碰撞均为有效碰撞
D. 加入反应物,使活化分子百分数增加,化学反应速率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)写出物质C的电子式 ;
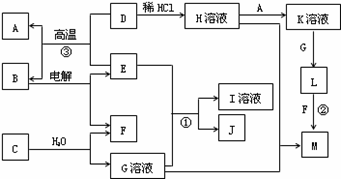 (4)写出②、③反应的离子方程式② ,③ 。
(4)写出②、③反应的离子方程式② ,③ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排放的废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是
A.Ag+、K+、NO3-、HCO3- B.K+、NH4+、NO3-、SO42-
C.Ag+、NH4+、Mg2+、HCO3- D.K+、Mg2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列三个氧化还原反应:① 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2 ;②2FeCl2 + Cl2 = 2FeCl3 ;③ 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O。若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不使Fe2+和Cl-的量减少,可加入的试剂是
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、Al、Fe四种金属的熔、沸点如下表所示:
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2467 | 2750 |
其中不能形成合金的是( )。
A.Cu与Na B.Fe与Cu C.Fe与Al D.Al与Na
查看答案和解析>>
科目:高中化学 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = ▲ 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图3:
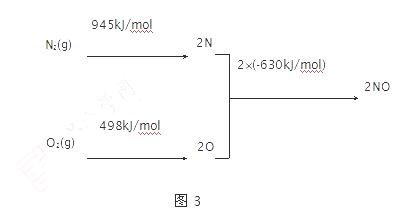
① N2(g)+O2(g) 2NO(g) ΔH= ▲ kJ·mol-1。
2NO(g) ΔH= ▲ kJ·mol-1。
② 尾气中空气不足时,NOx在催化转化器中被还原成N2。写出NO被CO还原的化学方程式 ▲ 。
③ 汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的ΔH>0,该设想能否实现? ▲ (填“能或不能”)。依据是 ▲ 。
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图4:
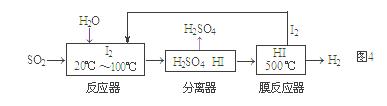
① 用离子方程式表示反应器中发生的反应 ▲ 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com