
关于右图所示装置(盐桥含KCl)的叙述,正确的是
A.铜离子在铜片表面被氧化
B.铜作阳极,铜片上有气泡产生
C.电流从锌片经导线流向铜片
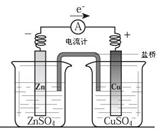 D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多
D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
 实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.2mol/L的盐酸溶液,填空并请回答下列问题:
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.2mol/L的盐酸溶液,填空并请回答下列问题:
 (1) 配制250mL0.2mol/L的盐酸溶液
(1) 配制250mL0.2mol/L的盐酸溶液
| 计算应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 除量筒、容量瓶、烧杯外还需的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _ __ __;
 A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
 B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
 C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
 D.将容量瓶盖紧,振荡,摇匀
D.将容量瓶盖紧,振荡,摇匀
 E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
 F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
 (3)操作A中,将洗涤液都移入容量瓶,其目的是 ____ ,
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ____ ,
 (4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作 ;
若加蒸馏水时不慎超过了刻度 ;
若定容时俯视刻度线___________________。
 (5)若实验过程中出现如下情况如何处理?
(5)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面__________________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学研究的重要方法之一,下列有关说法中,正确的是
A.SO2、NO2、和CO2都属于酸性氧化物
B.甲烷和和一氯甲烷都属于烷烃
C.HC1O是弱电解质,NaClO却属于强电解质
D.在水溶液中能电离出H+的化合物都属于酸
查看答案和解析>>
科目:高中化学 来源: 题型:
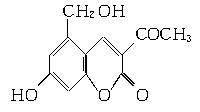 2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式
___________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与3 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子:⑴I-、Fe2+、NO3-、H+ ⑵K+、NH4+、HCO3-、OH- ⑶SO32-、SO42-、K+、OH-
⑷Fe2+、Cu2+、SO42-、Cl- ⑸Fe3+、SCN-、K+、SO42- ⑹H+、K+、AlO2-、HSO3- 在溶液中能大量共存且溶液为无色的组别共有
A.1组 B.2组 C.3组 D.不少于4组
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大
B. 升高温度,使活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的分子间的碰撞均为有效碰撞
D. 加入反应物,使活化分子百分数增加,化学反应速率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)写出物质C的电子式 ;
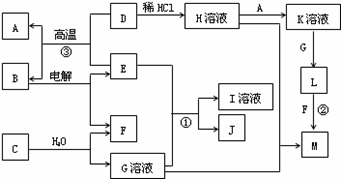 (4)写出②、③反应的离子方程式② ,③ 。
(4)写出②、③反应的离子方程式② ,③ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列三个氧化还原反应:① 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2 ;②2FeCl2 + Cl2 = 2FeCl3 ;③ 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O。若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不使Fe2+和Cl-的量减少,可加入的试剂是
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.NH3溶于水后所得溶液显碱性,在硫酸铜溶液中加入足量氨水可产生氢氧化铜沉淀
B.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污
C.次氯酸钠具有强还原性,可用于配制“84”消毒液
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com