
 外,还含有的官能团名称是碳碳双键和酯基;
外,还含有的官能团名称是碳碳双键和酯基; .
.
分析 (1)根据H的结构简式可确定H中的官能团;
(2)①比较B和C的结构简式可知化合物M的结构简式;
②比较D和F的结构简式及两步反应的条件可知E为CH3C≡CCOOH,据此写E→F的化学方程式;
(3)a.根据A和B的结构简式可知,A有一个碳参键,而B中有一个碳碳双键和一个碳碳参键;
b.根据乙烯中所有原子共面,乙炔中所有原子共线判断;
c.根据G的结构简式可知,G的分子式为C11H16O3,根据氢元素守恒可知lmol G完全燃烧生成8mol H2O
d.H中有碳碳双键,能被酸性高锰酸钾溶液氧化;
(4)根据H的结构简式,结合条件:①核磁共振氢谱表明,除苯环上的氢,分子中其它氢原子化学环境相同,说明苯环上的取代基分布很对称,②分子中存在甲氧基(-0CH3),据此写同分异构体的结构简式.
解答 解:(1)根据H的结构简式可知H中的官能团为碳碳双键和酯基,
故答案为:碳碳双键和酯基;
(2)①比较B和C的结构简式可知化合物M的结构简式为CH3OH,
故答案为:CH3OH;
②比较D和F的结构简式及两步反应的条件可知E为CH3C≡CCOOH,所以E→F的化学方程式为CH3C≡CCOOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3C≡CCOOCH2CH3+H2O,
故答案为:CH3C≡CCOOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3C≡CCOOCH2CH3+H2O;
(3)a.根据A和B的结构简式可知,A有一个碳参键,而B中有一个碳碳双键和一个碳碳参键,所以A和B不是同系物,故a错误;
b.根据乙烯中所有原子共面,乙炔中所有原子共线可知,B分子中所有原子共面,故b正确;
c.根据G的结构简式可知,G的分子式为C11H16O3,根据氢元素守恒可知lmol G完全燃烧生成8mol H2O,故c错误;
d.H中有碳碳双键,能被酸性高锰酸钾溶液氧化,所以H能使酸性高锰酸钾溶液褪色,故d正确;
故选bd;
(4)根据H的结构简式,结合条件:①核磁共振氢谱表明,除苯环上的氢,分子中其它氢原子化学环境相同,说明苯环上的取代基分布很对称,②分子中存在甲氧基(-0CH3),所以H的同分异构体的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,难度中等,理解题目给予给信息为解答该题的关键,注意掌握官能团的性质与转化.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
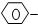 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| C. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 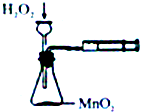 定量测定化学反应速率 | B. | 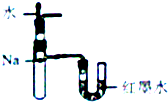 验证Na和水反应的热效应 | ||
| C. | 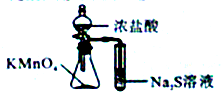 比较KMnO4、cl2、S的氧化性 | D. | 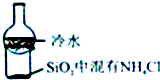 加热烧杯,分离SiO2和NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
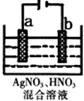 化学反应原理在生活和工业中应用广泛.
化学反应原理在生活和工业中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
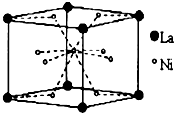 储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.
储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
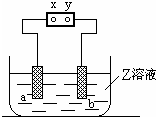
| a极板 | b极板 | X电极 | Z溶液 | |
| A | 石墨 | 石墨 | 正极 | NaOH |
| B | 铜 | 石墨 | 负极 | CuCl2 |
| C | 锌 | 石墨 | 负极 | CuSO4 |
| D | 银 | 铁 | 正极 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 体积不变,加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
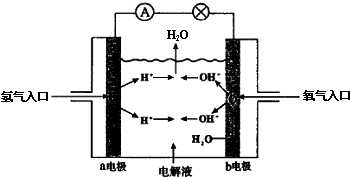
| A. | a电极是负极 | B. | b电极上发生氧化反应 | ||
| C. | 该电池工作时化学能转化为电能 | D. | 该电池的总反应为2H2+O2═2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com