
| n |
| V |


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、降低温度 | B、升高温度 |
| C、减小压强 | D、加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:Y<W |
| C、X与Y只能形成一种化合物 |
| D、Z2WY3可用来制备木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
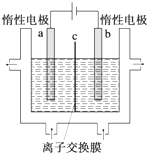 碘及其化合物在人类活动中占有重要地位.
碘及其化合物在人类活动中占有重要地位.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com