
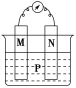
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 锌 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
【答案】C
【解析】
观察到电流计指针偏转;M棒变粗,N棒变细,说明构成原电池,而且N电极发生反应,作负极,溶液中的金属阳离子在M极上得到电子,生成金属单质,M变粗。
A、总反应为Zn+2H+=Zn2++H2↑,Zn作负极,发生Zn-2e-=Zn2+,M极变细,A错误;
B、总反应为Zn+2H+=Zn2++H2↑,M极上发生反应2H++2e-=H2↑,有气体生成,不会变粗,B错误;
C、总反应为Zn+2Ag+=Zn2++2Ag,Zn作负极,Zn-2e-=Zn2+,N极变细,溶液中的Ag+在M极,发生反应Ag++e-=Ag,变粗,C正确;
D、Zn比Fe活泼与Fe3+发生反应,Zn作负极,Zn-2e-=Zn2+,M极变细,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】电离能是衡量元素失电子能力的重要依据,随着元素核电荷数的递增,电离能值呈现周期性变化规律。根据所学知识,回答下列问题。
![]() 第一电离能指的是______。
第一电离能指的是______。
![]() 如图是部分元素原子的第一电离能
如图是部分元素原子的第一电离能![]() 随原子序数变化关系
随原子序数变化关系![]() 其中12号至17号元素的有关数据缺失
其中12号至17号元素的有关数据缺失![]() 。
。
![]() 根据图示变化规律,可推测S的第一电离能的大小
根据图示变化规律,可推测S的第一电离能的大小![]() 最小
最小![]() 范围为______
范围为______![]() ______
______![]() 填元素符号
填元素符号![]() 。
。
![]() 据图可知,同主族元素原子第一电离能
据图可知,同主族元素原子第一电离能![]() 变化规律是______。
变化规律是______。
![]() 图中第一电离能最小的元素在周期表中的位置______。
图中第一电离能最小的元素在周期表中的位置______。
![]() 根据对角线规则铍元素最高价氧化物的水化物应该具有______。
根据对角线规则铍元素最高价氧化物的水化物应该具有______。
![]() 用In表示元素的第n电离能,则图中的a、b、c分别代表______。
用In表示元素的第n电离能,则图中的a、b、c分别代表______。

A.a为![]() 、b为
、b为![]() 、c为
、c为![]()
B.a为![]() 、b为
、b为![]() 、c为
、c为![]()
C.a为![]() 、b为
、b为![]() 、c为
、c为![]() D.a为
D.a为![]() 、b为
、b为![]() 、c为
、c为![]()
![]() 铜、锌两种元素的第一电离能、第二电离能如表所示:
铜、锌两种元素的第一电离能、第二电离能如表所示:
电离能 |
|
|
Cu | 746 | 1958 |
Zn | 906 | 1733 |
铜的第一电离能![]() 小于锌的第一电离能,而铜的第二电离能
小于锌的第一电离能,而铜的第二电离能![]() 却大于锌的第二电离能,其主要原因是______。
却大于锌的第二电离能,其主要原因是______。
![]() 与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能
与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能![]() ,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能
,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能![]() ,部分元素或离子的电子亲和能数据如下表所示:
,部分元素或离子的电子亲和能数据如下表所示:
元素 | Cl | Br | I | O |
|
电子亲和能 | 349 | 343 | 295 | 141 |
|
![]() 下列说法中错误的是______。
下列说法中错误的是______。
A.元素的电子亲和能越大,越容易得到电子
B.一个基态的气态氧原子得到一个电子成为![]() 时放出141kJ的能量
时放出141kJ的能量
C.氧元素的第二电子亲和能是![]()
D.基态的气态氧原子得到两个电子成为![]() 需要吸收能量
需要吸收能量
![]() 图中数据显示,同主族元素
图中数据显示,同主族元素![]() 从上到下依次减小,其原因是_____。
从上到下依次减小,其原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
元素符号 | 元素性质或原子结构 |
T | 其一种无色氧化物遇空气变为红棕色 |
W | 其单质和化合物的焰色反应焰色均呈黄色 |
X | 基态原子的最外层电子排布式为 |
Y | 单质常温下为气体,可用于自来水消毒 |
Z | 一种核素的质量数为56,中子数为30 |
(1)Z元素位于周期表中第_ ______ 族,其基态原子的价层电子排布式为:______ ;
(2)T的一种化合物为![]() ,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
(3)W、X和Y三种元素中,第一电离能最小的为 ______ (填元素符号);W、X和Y的简单离子的半径从小到大的顺序为 ______ (用离子符号表示)。
(4)Z与水蒸气反应的化学方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y(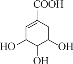 )是由中草药五倍子制备而成。
)是由中草药五倍子制备而成。
(1) Y属于_____填“无机化合物”或“有机化合物”)。
(2) Y中含氧官能团有羧基和_____(填名称)。
(3) 向Y溶液中滴入溴水,溴水褪色,说明Y中含有_____。
(4) Y具有还原性。向Y溶液中滴入几滴酸性KMnO4稀溶液,实验现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g) + B(g)xC(g) + 2D(g),经4min后,测得D的浓度为0.4mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1 mol·(L ·min) -1。下列说法错误的是
A.A在4min末的浓度是0.6mol/LB.B在4min内的平均反应速率0.05 mol.L -1·min -1
C.x值是1D.起始时物质A的浓度为2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硫技术可用于处理废气中的氮氧化物。发生的化学反应为:2NH3(g)+NO(g)![]() 2N2(g)+3H2O(g) ΔH<0在恒容密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g) ΔH<0在恒容密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度平衡向正反应方向移动
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是
A.强酸与强碱中和滴定时可以选用甲基橙或酚酞作指示剂;强碱与弱酸中和滴定时应该选用酚酞作指示剂
B.在5![]() 的
的![]() 溶液中加入3mL等浓度的NaCl溶液,有白色沉淀产生,再加入3mL等浓度的
溶液中加入3mL等浓度的NaCl溶液,有白色沉淀产生,再加入3mL等浓度的![]() 溶液,溶液中又有黑色沉淀生成,说明
溶液,溶液中又有黑色沉淀生成,说明![]()
C.物质的量浓度均为![]() 的弱酸HX及其盐NaX溶液等体积混合后:
的弱酸HX及其盐NaX溶液等体积混合后:![]()
![]()
D.已知![]() ,
,![]() 。在含
。在含![]() 、
、![]() 浓度相同的溶液中滴加
浓度相同的溶液中滴加![]() 溶液时,首先生成
溶液时,首先生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com