
【题目】2017年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
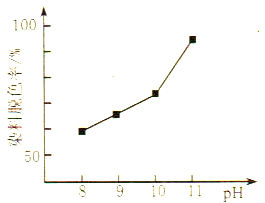
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由:__________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
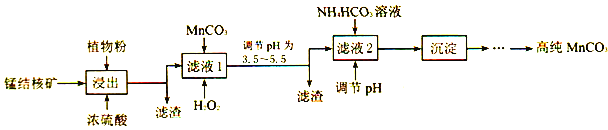
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
【答案】 MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O MnO2+2H++H2O2=Mn2++2H2O+O2↑ 其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好 pH增大,c(OH-)增大,促使H2O2===HO2-+H+正向移动,c(HO2-)增大,漂白效果越好 作还原剂 不引入新杂质 减少碳酸玺被分解,提高原料利用率 5
【解析】(1)MnO2和浓盐酸加热反应得到氯化锰、氯气和水,化学方程式MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;正确答案:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O。
(2)①根据题给信息可知MnO2在酸性条件下与H2O2反应,MnO2被还原为锰离子,H2O2被氧化为氧气,反应的离子方程式:MnO2+2H++H2O2=Mn2++2H2O+O2↑;正确答案:MnO2+2H++H2O2=Mn2++2H2O+O2↑。
②根据图像可知:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;原因:pH增大,c(OH-)增大,促使H2O2![]() HO2-+H+正向移动,c(HO2-)增大,漂白效果越好;正确答案:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;pH增大,c(OH-)增大,促使H2O2
HO2-+H+正向移动,c(HO2-)增大,漂白效果越好;正确答案:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;pH增大,c(OH-)增大,促使H2O2![]() HO2-+H+正向移动,c(HO2-)增大,漂白效果越好。
HO2-+H+正向移动,c(HO2-)增大,漂白效果越好。
(3) ①根据流程可知,二氧化锰中+4价锰变为碳酸锰中+2价锰,发生还原反应,植物粉起到还原剂的作用,可用SO2代替植物粉,植物粉的作用是作还原剂,正确答案:作还原剂。
②碳酸锰不溶于水,能够与酸反应,调节溶液的pH,不引入新的杂质;正确答案:不引入新的杂质。
③NH4HCO3在温度较高时,易发生分解,因此在加入NH4HCO3时,温度要控制在35℃以下,减少碳酸氢铵的分解,提高原料利用率;正确答案:减少碳酸氢铵的分解,提高原料利用率。
(4) Mn2+开始沉淀时溶液中硫离子浓度是1.4×1015÷0.020 mol·L1=7.0×1014 mol/L,根据K2=7.0×1015,可知溶液中氢离子浓度是![]() ,所以pH=5;正确答案:5。
,所以pH=5;正确答案:5。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是 ( )
A.NH3易溶于水,可用作制冷剂
B.ClO2具有还原性,可用于自来水的杀菌消毒
C.SiO2硬度大,可用于制造光导纤维
D.Na2O2吸收二氧化碳产生氧气,可用作呼吸面具供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应是放热反应
B.反应物的总能量高于生成物的总能量时发生吸热反应
C.化学反应中的能量变化,通常表现为热量的变化
D.木炭在氧气中的燃烧是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是
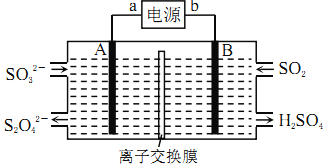
A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。
(1)A、E元素的元素符号:A __________、E ____________
(2)AB2的电子式为____________________
(3)DB2使澄清石灰水变浑浊的化学方程式:__________________________________
(4)E的单质与NaOH溶液反应的离子方程式: ________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的连接并填空: 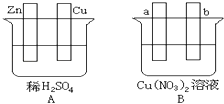
(1)在A图中,使铜片上冒H2气泡.请加以必要连接,则连接后的装置叫 . 电极反应式:锌板:;铜板: .
(2)在B图中,使a极析出铜,则b析出: . 加以必要的连接后,该装置叫 . 电极反应式,a极: b极: . 在经过一段时间后,停止反应并搅均溶液,溶液的pH(升高、降低、不变),加入一定量的后,溶液能恢复至与电解前完全一致.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数可以用 K 来表示,下列关于 K 的说法中正确的是( )
A. K 越大,反应物的转化率越小 B. K 与温度一定有关
C. K 与生成物的浓度一定有关 D. K 与反应物的浓度一定有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76gL﹣1;W的质子数是X、Y、Z、M四种元素质子数之和的 ![]() .下列说法正确的是( )
.下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质可能导电
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com