
【题目】化学平衡常数可以用 K 来表示,下列关于 K 的说法中正确的是( )
A. K 越大,反应物的转化率越小 B. K 与温度一定有关
C. K 与生成物的浓度一定有关 D. K 与反应物的浓度一定有关
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】2017年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
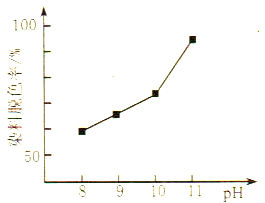
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由:__________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
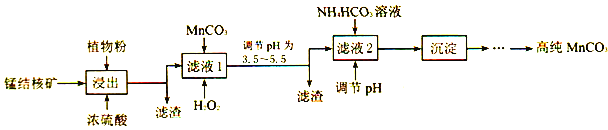
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
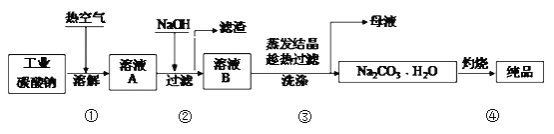
下列说法不正确的是
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3H2O中混有Na2CO310H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(5分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
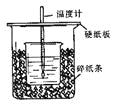
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,是吸热反应的是( )
A.铝片与稀硫酸反应B.乙醇在空气中燃烧
C.盐酸与氢氧化钠溶液反应D.Ba(OH)28H2O晶体与氯化铵晶体反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,W单质的熔沸点最高
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示。下列说法正确的是

A. 电极b为电池负极
B. 电路中每流过4mol电子,正极消耗44.8LH2S
C. 电极b上的电极反应为:O2+4e-+4H+=2H2O
D. 电极a上的电极反应为:2H2S+2O2--4e-=S2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com