
| A. | NF3 | B. | C${H}_{3}^{-}$ | C. | SO3 | D. | H3O+ |
分析 根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型,VSEPR模型名称与该粒子的立体构型名称一致,说明中心原子孤电子对数为0.
解答 解:VSEPR模型名称与该粒子的立体构型名称一致,说明中心原子孤电子对数为0.
A.NF3中N原子孤电子对数=$\frac{5-3}{2}$=1,价层电子对数为3+1=4,VSEPR模型为四面体,而微粒空间构型为三角锥形,故A错误;
B.CH3-中C原子孤电子对数=$\frac{4+1-1×3}{2}$=1,价层电子对数为3+1=4,VSEPR模型为四面体,而微粒空间构型为三角锥形,故B错误;
C.SO3中S原子孤电子对数=$\frac{6-2×3}{2}$=0,价层电子对数为3+0=3,VSEPR模型、微粒空间构型为平面三角形,故C正确;
D.H3O+中O原子孤电子对数=$\frac{6-1-1×3}{2}$=1,价层电子对数为3+1=4,VSEPR模型为四面体,而微粒空间构型为三角锥形,故D错误.
故选:C.
点评 本题考查了价层电子对互斥模型和微粒的空间构型的关系,掌握孤电子对个数的计算方法,为易错点,注意实际空间构型要去掉孤电子对,题目难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO2+2H2S═3S↓+2H2O | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | AgNO3+NaCl═AgCl↓+NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型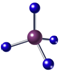 | |
| B. | Cl-的结构示意图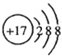 | |
| C. | 中子数为8的碳原子的核素符号为12C | |
| D. | 中子数为1的氢原子的核素符号为21H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
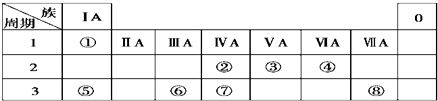
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M一定是金属元素 | B. | M一定是S区元素 | C. | M的最高价是+1价 | D. | M可能呈现出-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、E一定处于1、2、3三个不同周期 | |
| B. | A、D不可能在同一主族 | |
| C. | C的最高氧化物的水化物可能显碱性 | |
| D. | C和D的单质不可能化合成1:1型离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| X | Y | Z | W | R | P | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
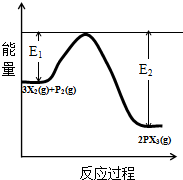
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (c-a-b)kJ | B. | (a+b-c)kJ | C. | (2c-a-b)kJ | D. | $\frac{2c-a-b}{2}$kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com