
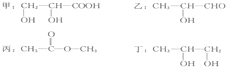
| y |
| 4 |
| z |
| 2 |
| y |
| 4 |
| z |
| 2 |
| NaOH |
| △ |
| NaOH |
| △ |


科目:高中化学 来源: 题型:
| A、c(OH-)<c(H+)<c(B+)<c(A-) |
| B、c(OH-)=c(H+)+c(HA) |
| C、c(H+)+c(B+)<c(A-)+c(OH-) |
| D、c(A-)=c(B+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
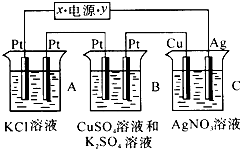 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 次数 | 镁带质量 (g) | 硫酸体积 (mL) | C瓶中液体体积(mL) | 抽出气体的体积 (mL) | 氢气体积 (mL) | 计算1mol氢气体积(L) 两次实验的平均值(保留一位小数) |
| 1 | 0.120 | 10.0 | 119.3 | 8.0 | ||
| 2 | 0.112 | 10.0 | 115.7 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
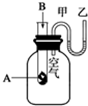 为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清的石灰水与盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | ||||
| B、钠与水的反应:Na+2H2O=Na++2OH-+H2↑ | ||||
C、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO
| ||||
| D、大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com