
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=___________。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H=______________;
2CO(g)+2H2(g) 的△H=______________;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是___________________________________;
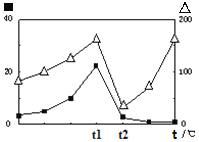 (代表CO的生成速率,■代表催化剂的催化效率)
(代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向__________(填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式:_____________;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为______。
【答案】64 +1379.3 kJ·mol-1 温度超过250℃时,催化剂的催化效率降低 减小压强或增大CO2的浓度 逆反应 ![]() CO2+8e-+6H2O=CH4+8OH-
CO2+8e-+6H2O=CH4+8OH-
【解析】
(1)①根据表中数据,由平衡体系中各组分体积分数可计算各物质的平衡浓度,设平衡时CO2的消耗浓度是x,则甲烷的消耗浓度也是x,CO、H2的平衡浓度则为2x,所以有
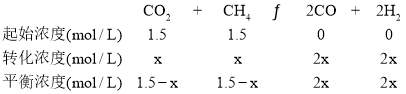
根据题意可得2x/(3+2x)=0.4,解得x=1,所以CO2、CH4、CO、H2的平衡浓度分别是0.5mol/L、0.5mol/L、2mol/L、2mol/L,所以该温度下的平衡常数K=![]() =64;
=64;
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJmol-1ⅰ
CO(g)+H2O(g)=CO2(g)+H2(g)△H=2.8kJmol-1ⅱ
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJmol-1ⅲ
根据盖斯定律,由ⅰ+ⅱ×2-ⅲ×2得,CO2(g)+CH4(g)2CO(g)+2H2(g)△H=-890.3kJmol-1+2.8kJmol-1×2+566.0kJmol-1×2=+247.3 kJmol-1;
③由图可知,t1~t2℃时,温度升高,催化剂的催化效率降低,所以温度升高乙酸的生成速率降低;
④正反应体积增大,则减小反应压强、增大CO2的浓度,平衡正向移动,甲烷的转化率增大;
⑤同时充入2.0mol CO2、6.0mol CH4、4.0mol CO和8.0mol H2,则各物质浓度分别为:c(CO2)=1mol/L,c(CH4)=2mol/L,c(CO)=3mol/L,c(H2)=4mol/L,浓度商为42×32/(1×2)=72>64,所以化学平衡向逆反应方向移动;
(2)①CO2分子内含有碳氧双键,根据加聚反应特点,生成高聚物结构简式为:![]() ;
;
②根据题意,CO2转化为甲烷,C元素化合价降低,发生还原反应,结合电解质溶液得电极反应为:CO2+8e-+6H2O=CH4+8OH-。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
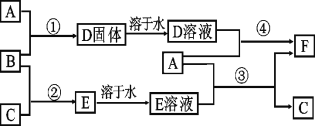
请回答:
(1)写出B物质的化学式:_______;F的化学名称:_______。
(2)写出第②步C在B中燃烧的反应现象:_______。
(3)写出第④步反应的化学反应方程式_______。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____,写出该反应的化学方程式_____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“类推思维”是化学解题中常用的思维方法,类推的结论最终要经过实践的检验,才能决定其正确与否。下列类推结论中正确的是
A.钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
B.铝在空气中生成氧化膜保护内层金属;铁在空气中生成氧化膜也保护内层金属
C.Al(OH)3、Cu(OH)2受热易分解;Fe(OH)3受热也易分解
D.Fe与CuSO4溶液反应能置换Cu;Na与CuSO4溶液反应也能置换Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最早使用的化学电池是锌锰电池,即大家熟悉的干电池,其结构如图所示。

尽管这种电池的历史悠久,但对于它的化学过程人们尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2e-+2NH4+===Mn2O3+H2O+2NH3↑
F极:Zn-2e-===Zn2+
总反应式:2MnO2+Zn+2NH4+===Mn2O3+Zn2++2NH3↑+H2O
下列说法正确的是
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )
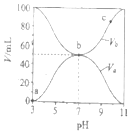
A.Ka(HA)=1×10-6mol/L
B.b点c(B+)=c(A-)=c(OH-)=c(H+)
C.c点时,![]() 随温度升高而减小
随温度升高而减小
D.a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如下图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积。
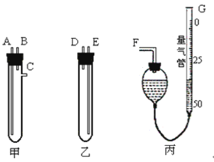
假如实验是在标准状况下进行,试回答下列问题:
(1)镁带和稀硫酸应分别置于_________、_________仪器中(填仪器编号);G管可以用化学实验室里的一种常用仪器来改装,你认为这种仪器的名称是__________________。
(2)仪器丙由左、右两根部分组成,它们用橡皮管连通,并装入适量水,上下移动两管可以调节液面高低。甲乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,接口的连接方式如下:A接连_________,B接连_________,C接连_________ (填写各接口的编号)。
(3)实验中要取用一定质量的镁条样品投入图示试管中,你认为能否用中学化学实验室常用的托盘天平_________,理由是____________。
(4)你认为可用什么方法取镁带样品_________。如果取镁带长l m,质量为 m g,截取镁带长x cm,产生气体体积为V mL,则测得标况下气体摩尔体积应表示为:V(m)= _________Lmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
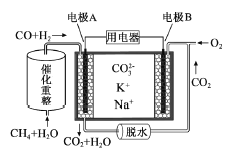
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应原理判断正确的是( )
A.若一定条件下,反应![]() 达平衡后,压缩容器,则反应物浓度增大,平衡正向移动
达平衡后,压缩容器,则反应物浓度增大,平衡正向移动
B.已知水合肼(![]() )是二元弱碱,能发生类似于多元酸的电离形式,则在水中它的第二步电离方程式为
)是二元弱碱,能发生类似于多元酸的电离形式,则在水中它的第二步电离方程式为![]()
C.同温同压下,![]() 在光照和点燃条件下的
在光照和点燃条件下的![]() 不同
不同
D.在一定条件下的![]() 溶液,若升高温度,则
溶液,若升高温度,则![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com