
【题目】某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如下图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积。
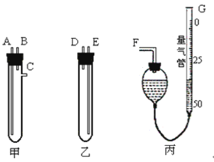
假如实验是在标准状况下进行,试回答下列问题:
(1)镁带和稀硫酸应分别置于_________、_________仪器中(填仪器编号);G管可以用化学实验室里的一种常用仪器来改装,你认为这种仪器的名称是__________________。
(2)仪器丙由左、右两根部分组成,它们用橡皮管连通,并装入适量水,上下移动两管可以调节液面高低。甲乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,接口的连接方式如下:A接连_________,B接连_________,C接连_________ (填写各接口的编号)。
(3)实验中要取用一定质量的镁条样品投入图示试管中,你认为能否用中学化学实验室常用的托盘天平_________,理由是____________。
(4)你认为可用什么方法取镁带样品_________。如果取镁带长l m,质量为 m g,截取镁带长x cm,产生气体体积为V mL,则测得标况下气体摩尔体积应表示为:V(m)= _________Lmol-1。
【答案】甲 乙 50mL碱式滴定管 D E F 不能 量气管的最大量程是50mL,只需0.05g左右镁样品,托盘天平的精度是0.1g,无法用托盘天平称量 用标准卷尺量取镁带 ![]()
【解析】
(1)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管后发生反应;G管可以用50 mL碱式滴定管改装;
(2)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管,B、E相连起到平衡气压的作用,生成的氢气经C、F通入丙装置中,由G读出氢气的体积;
(3)量气管的最大量程是50 mL,只需0.05 g左右镁带样品;
(4)根据氢气的物质的量、氢气的体积计算气体摩尔体积。
(1)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管后发生反应;根据图示,G管可以用50mL碱式滴定管改装;
(2)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管,B、E相连起到平衡气压的作用,生成的氢气经C、F通入丙装置中,由G读出氢气的体积,所以A接连D,B接连E,C接连F;
(3)因量气管的最大体积是50mL,经计算可知镁带的质量只能是0.05g左右,而托盘天平的最小量程为0.1g,不能使用托盘天平称量;
(4)已知镁带每米质量为2.5g左右,所以可以用标准卷尺量取镁带;如果镁带长1m,质量为mg,现截取镁带长xcm,则镁的质量是![]() ,物质的量是
,物质的量是![]() ,产生氢气的物质的量为
,产生氢气的物质的量为![]() ,
,![]() ,Vm=
,Vm=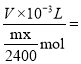
![]() Lmol-1 。
Lmol-1 。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知有机物a和苯反应生成有机物b。下列分析正确的是
![]() + HCl
+ HCl
A.该反应是加成反应
B.若R为CH3,b中所有原子可能共面
C.若R为CH3,b的一氯代物共有3种
D.若R为C4H9,b可能的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探索二氧化碳在海洋中转移和归宿,是当今海洋科学研究的前沿领域。研究表明,溶于海水的二氧化碳主要以无机碳形式存在,其中HCO3-占95%。科学家利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

下列说法不正确的是
A. a室中OH-在电极板上被氧化
B. b室发生反应的离子方程式为:H+ + HCO3- = CO2↑ + H2O
C. 电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
D. 若用氢氧燃料电池供电,则电池负极可能发生的反应为:H2 + 2OH- - 2e- =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。下列说法不正确的是:
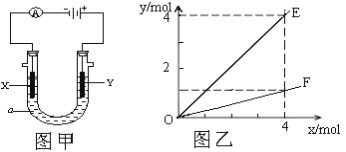
A.若此装置用于电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液。
B.按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量。
C.若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1
D.按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氧化铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为0.4mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=___________。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H=______________;
2CO(g)+2H2(g) 的△H=______________;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是___________________________________;
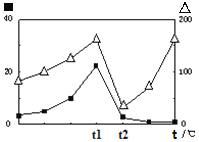 (代表CO的生成速率,■代表催化剂的催化效率)
(代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向__________(填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式:_____________;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室以铜和浓硫酸为原料,采用两种方法制取胆矾。制备方法如下:
方法一:将铜屑放入浓硫酸中加热
(1)写出该反应的化学方程式______________。
(2)浓硫酸试剂瓶上贴的标签应该是______________(填字母选项)。
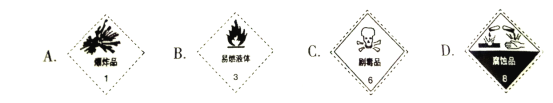
(3)通过上述反应后,经过一系列操作,若最终得到胆矾晶体25.0g,则被还原的H2SO4的物质的量为____________mol。
方法二:将铜屑置入稀硫酸中,加热并不断鼓入空气,该反应的化学方程式为:2Cu+ H2SO4+O2![]() 2 CuSO4+2H2O
2 CuSO4+2H2O
(4)写出该反应的离子方程式:____________________________。
(5)上述反应中氧化剂和还原剂的物质的量之比为___________。
(6)充分反应后,将制得的硫酸铜溶液经过蒸发浓缩、___________,过滤,即可得到胆矾晶体。
(7)对比两种方法,方法二相对于方法一有两个明显的优点:
①制取等质量的胆矾消耗的硫酸的量少;
②__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. MgSO4溶液与Ba(OH)2溶液混合:Ba2++![]()
![]() BaSO4↓
BaSO4↓
B. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:![]() +
+![]() +H2O
+H2O![]() Al(OH)3↓+
Al(OH)3↓+![]()
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2
2![]() +3Cl+4H++H2O
+3Cl+4H++H2O
D. 用稀硝酸洗涤试管内壁的银镜:Ag+4H++![]()
![]() Ag++NO↑+2H2O
Ag++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
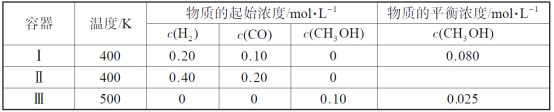
A.该反应的正反应吸热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A.容器内压强不随时间变化
B.V正(X)=V逆(Z)
C.容器内X、Y、Z的浓度之比为l∶2∶2
D.单位时间消耗0.1molX同时生成0.2molZ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com