
【题目】在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A.容器内压强不随时间变化
B.V正(X)=V逆(Z)
C.容器内X、Y、Z的浓度之比为l∶2∶2
D.单位时间消耗0.1molX同时生成0.2molZ
【答案】A
【解析】
反应达到平衡的标志有速率标志,即正逆反应速率相等;“量”的标志,即浓度、n、含量、p等保持一定,结合反应方程式解析如下。
A、这是一个反应前后气体物质的量不等的反应,即压强会改变,所以当压强不随时间变化时说明反应已达平衡,故A正确;
B、v正(X)=v逆(Z),尽管体现了正逆两个方向的速率,但是速率数值之比不等于计量系数之比,说明正逆反应速率不相等,反应没有达到平衡状态,B错误;
C、平衡时容器内各物质的浓度之比与其开始时加入的量有关,所以浓度之比等于对应的计量系数之比,不能说明反应已达平衡状态,C错误;
D、单位时间内消耗0.1molX,是正向速率,同时生成0.2molZ也是正向速率,同一方向的速率不能说明反应已达平衡状态,D错误;
本题答案为A。


科目:高中化学 来源: 题型:
【题目】某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如下图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积。
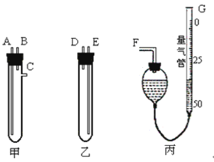
假如实验是在标准状况下进行,试回答下列问题:
(1)镁带和稀硫酸应分别置于_________、_________仪器中(填仪器编号);G管可以用化学实验室里的一种常用仪器来改装,你认为这种仪器的名称是__________________。
(2)仪器丙由左、右两根部分组成,它们用橡皮管连通,并装入适量水,上下移动两管可以调节液面高低。甲乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,接口的连接方式如下:A接连_________,B接连_________,C接连_________ (填写各接口的编号)。
(3)实验中要取用一定质量的镁条样品投入图示试管中,你认为能否用中学化学实验室常用的托盘天平_________,理由是____________。
(4)你认为可用什么方法取镁带样品_________。如果取镁带长l m,质量为 m g,截取镁带长x cm,产生气体体积为V mL,则测得标况下气体摩尔体积应表示为:V(m)= _________Lmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O反应,下列说法不正确的是( )
CH3COOCH2CH3+H2O反应,下列说法不正确的是( )
A. 浓硫酸不是反应物B. 浓硫酸作催化剂C. 属于取代反应D. 属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
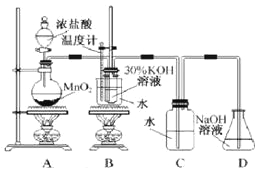
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有__。
(2)若对调B和C装置的位置,__(填“能”或“不能”)提高B中氯酸钾的产率。
实验二:氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
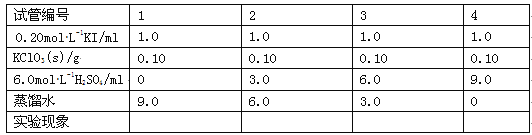
①系列a实验的实验目的是__。
②设计1号试管实验的作用是__。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__。
实验三:测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__。(不考虑实验装置及操作失误导致不可行的原因)
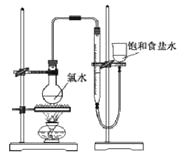
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):__。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应原理判断正确的是( )
A.若一定条件下,反应![]() 达平衡后,压缩容器,则反应物浓度增大,平衡正向移动
达平衡后,压缩容器,则反应物浓度增大,平衡正向移动
B.已知水合肼(![]() )是二元弱碱,能发生类似于多元酸的电离形式,则在水中它的第二步电离方程式为
)是二元弱碱,能发生类似于多元酸的电离形式,则在水中它的第二步电离方程式为![]()
C.同温同压下,![]() 在光照和点燃条件下的
在光照和点燃条件下的![]() 不同
不同
D.在一定条件下的![]() 溶液,若升高温度,则
溶液,若升高温度,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某度旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如下表:

(1)滤液A的主要成分除NaOH外,还有_____________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:_______________________________________________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2
c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质.写出反应Ⅱ中CuS发生反应的化学方程式:____________________________________________。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,饱和石灰水的溶解度为sg,密度为ρg/mL,向足量该饱和溶液中加入mgCaO,充分作用后,恢复到原来温度,下列有关说法不正确的是( )
A. 最终得到沉淀的质量大于![]() g
g
B. 该饱和溶液质量百分比浓度为:![]() %
%
C. 最终所得溶液pH不变
D. 该饱和溶液中溶质物质的量浓度为:![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验过程中,下列溶液的导电能力变化不大的是
A. ![]() 溶液中滴入
溶液中滴入![]() 溶液至过量
溶液至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水中通入![]() 至过量
至过量
D. ![]() 溶液中加入适量的NaOH固体
溶液中加入适量的NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(In1-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]___;Ga、In、Se,第一电离能从大到小顺序为___。
(2)硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是___。常温常压下,SiF4呈气态,而SiCl4呈液态,其主要原因是___。
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为___。
(4)SeO32-的立体构型为___;SeO2中硒原子采取杂化类型是___。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。
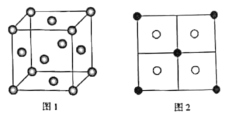
①CuS晶体中,相邻的两个铜离子间的距离为___pm。
②Cu2S晶体中,S2-的配位数为___。
③Cu2S晶体的密度为ρ=___g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com