
【题目】电解原理在化学工业中有广泛应用。图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。下列说法不正确的是:
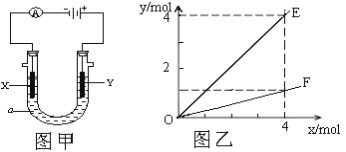
A.若此装置用于电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液。
B.按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量。
C.若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1
D.按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氧化铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为0.4mol。
【答案】D
【解析】
A. 电镀池中镀件作阴极、镀层金属作阳极、含有镀层金属的盐溶液作电解质,若此装置用于电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液,故A正确;
B. 按图甲装置用惰性电极电解AgNO3溶液,生成银、硝酸、氧气,转移4mol电子生成4mol硝酸、1mol氧气,若图乙横坐标x表示流入电极的电子的物质的量,则E表示反应生成硝酸的物质的量,F表示电解生成氧气的物质的量,故B正确;
C. 若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,阳极生成0.25mol氧气,阴极生成铜和0.25mol氢气,根据电子守恒,原溶液中铜离子的物质的量为![]() 0.25mol,则原混合液中CuSO4的物质的量浓度为
0.25mol,则原混合液中CuSO4的物质的量浓度为![]() 1mol·L-1,故C正确;
1mol·L-1,故C正确;
D. 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氧化铜刚好恢复到通电前的浓度和pH,说明电解过程中阴极生成0.1mol铜,则电解过程中转移的电子为0.2mol,故D错误;
选D。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
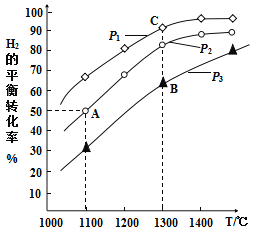
【题目】钼(Mo)是人体及动植物必需的微量元素,且在芯片制作、药物和医学造影等方面也有重要作用。用辉钼矿冶炼金属钼的某反应:MoS2(s)+2Na2CO3(s)+4H2(g)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),该反应中氢气的平衡转化率与温度、压强的关系如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),该反应中氢气的平衡转化率与温度、压强的关系如图所示:
(1)Na2S的电子式为:____________。上述反应的气态反应物和生成物中属于极性分子的是____________(填写化学式)。举出一个事实,说明硫的非金属性比碳强(用化学方程式表示)____________。
(2)写出上述反应的平衡常数表达式K=____________。上述正反应是____________反应(填“吸热”或“放热”)。
(3)1100℃,2L恒容密闭容器中,加入0.1molMoS2、0.2molNa2CO3、0.4molH2,反应至20min时达到的平衡状态恰好处于上图中的A点。此过程中,用H2表示的平均速率为____________。其他条件一定时,B点的速率____________C点(填“大于”“等于”或“小于”),说明理由:____________。
(4)A、B、C三点代表的平衡状态的平衡常数的大小为:KA____________KB____________KC(填“大于”“等于”或“小于”),并说明理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的密闭容器中,采用不同条件进行反应N2(g)+3H2(g)![]() 2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(N2)=0.2mol/(Ls)B.v(NH3)=0.8mol/(Lmin)
C.v(H2)=0.3mol/(Ls)D.v(H2)=1.3mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:

实验I:将Fe3+转化为Fe2+
(1)Fe3+与Cu粉发生反应的离子方程式为:_________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
步骤2:取______________,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓+I2
则Cu2+与SCN-反应的离子方程式为________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色 消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因____________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ_______(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最早使用的化学电池是锌锰电池,即大家熟悉的干电池,其结构如图所示。

尽管这种电池的历史悠久,但对于它的化学过程人们尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2e-+2NH4+===Mn2O3+H2O+2NH3↑
F极:Zn-2e-===Zn2+
总反应式:2MnO2+Zn+2NH4+===Mn2O3+Zn2++2NH3↑+H2O
下列说法正确的是
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如下图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积。
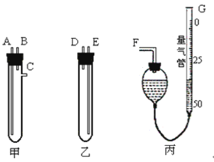
假如实验是在标准状况下进行,试回答下列问题:
(1)镁带和稀硫酸应分别置于_________、_________仪器中(填仪器编号);G管可以用化学实验室里的一种常用仪器来改装,你认为这种仪器的名称是__________________。
(2)仪器丙由左、右两根部分组成,它们用橡皮管连通,并装入适量水,上下移动两管可以调节液面高低。甲乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,接口的连接方式如下:A接连_________,B接连_________,C接连_________ (填写各接口的编号)。
(3)实验中要取用一定质量的镁条样品投入图示试管中,你认为能否用中学化学实验室常用的托盘天平_________,理由是____________。
(4)你认为可用什么方法取镁带样品_________。如果取镁带长l m,质量为 m g,截取镁带长x cm,产生气体体积为V mL,则测得标况下气体摩尔体积应表示为:V(m)= _________Lmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
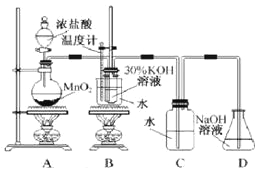
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有__。
(2)若对调B和C装置的位置,__(填“能”或“不能”)提高B中氯酸钾的产率。
实验二:氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
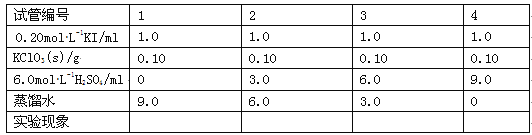
①系列a实验的实验目的是__。
②设计1号试管实验的作用是__。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__。
实验三:测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__。(不考虑实验装置及操作失误导致不可行的原因)
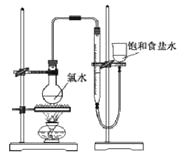
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):__。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com