
【题目】有机物A既能使溴水褪色,又能与碳酸钠溶液反应放出CO2 . A与CnH2n+1OH反应生成分子式为Cn+3H2n+4O2的酯,回答以下问题:
(1)A的分子式为: , 结构简式为: .
(2)已知含碳碳双键的有机物与卤化氢发生加成反应时,氢原子总是加到含氢较多的双键碳原子上.依此规则,A与HBr发生加成反应生成的物质B的结构简式为: .
(3)B与足量NaOH溶液发生反应生成C的化学方程式是: .
(4)C处理后,一定条件下生成的聚合物的结构简式为: .
【答案】
(1)C3H4O2,CH2=CHCOOH
(2)CH3CHBrCOOH
(3)CH3CHBrCOOH+2NaOH→CH3CHOHCOONa+NaBr+H2O
(4)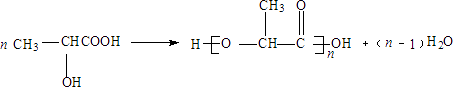
【解析】解:(1)A与CnH2n+1OH反应生成分子式为Cn+3H2n+4O2的酯,则可知A的分子式为C3H4O2,A能使溴水褪色,说明A中有碳碳不饱和键,能与碳酸钠溶液反应放出CO2,说明A中有羧基,据此可推断A的结构简式为CH2=CHCOOH;
(2)因为含碳碳双键的有机物与卤化氢发生加成反应时,氢原子总是加到含氢较多的双键碳原子上,所以B的结构简式为CH3CHBrCOOH;
(3)CH3CHBrCOOH与NaOH混合并加热,发生卤代物的碱性水解,卤原子被取代成羟基,同时发生中和反应,所以生成物C的结构简式为CH3CHOHCOONa,反应的化学方程式为CH3CHBrCOOH+2NaOH→CH3CHOHCOONa+NaBr+H2O;
(4)反应的方程式为 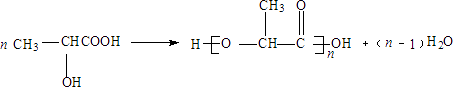 ;
;
所以答案是:(1)C3H4O2;CH2=CHCOOH;(2)CH3CHBrCOOH;(3)CH3CHBrCOOH+2NaOH→CH3CHOHCOONa+NaBr+H2O;(4)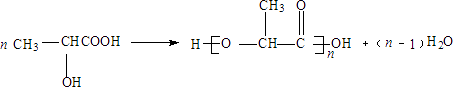


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在组成人体的各种化学元素中,最基本元素、含量最多的元素、占细胞干重最多的元素依次是
A.C、O、C B.C、H、O C.C、O、N D.C、O、O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂.某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(夹持装置和A中加热装置已略,气密性已检验) 
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2═HNO3+2NO↑+H2O;
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热。
(1)A中反应的化学方程式是_________________________________________。
(2)B中观察到的主要现象是_______________________。D装置的作用是___________________。
(3)实验经改进后可制得较纯亚硝酸钠,下列关于亚硝酸钠的说法正确的是________。
a.亚硝酸钠有咸味,可代替食盐食用
b.常温下,0.1mol/L亚硝酸溶液pH=1
c.0.1mol/L亚硝酸钠溶液中存在:c(Na+)+c(H+)=c(NO2﹣)+c(OH﹣)
d.0.1mol/L亚硝酸钠溶液中存在:c(NO2﹣)>c(Na+)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
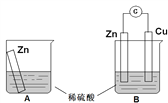
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是工业上的重要反应:N2(g)+3H2(g)![]() 2NH3(g),下列说法不正确的是
2NH3(g),下列说法不正确的是
A. 反应达平衡状态后,各物质浓度不变,反应停止
B. 反应达平衡状态后,单位时间内生成1mol N2的同时消耗3mol H2
C. 在上述条件下,N2不可能100%转化为NH3
D. 使用催化剂是为了加快反应速率,提高生产效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
Ⅰ | Ⅱ | Ⅲ | |
实验操作 示意图 |
|
|
|
实验现象 | 有极少量气泡产生 | 产生气泡速率略有加快 | 产生气泡速率明显加快 |
(1)实验Ⅰ的作用是_______________。
(2)实验Ⅲ中反应的化学方程式为_______________。
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②_______________。
(4)在一定温度下,10 mL 0.40 mol/L,H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
0~6 min,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。(计算结果精确到0.001)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期主族元素z、e、g、h,其最高价氧化物对应水化物溶液(浓度均为0.01molL﹣1)的pH与原子序数的关系如图所示。下列说法正确的是

A. 离子半径大小 e>g>h
B. g位于第三周期VA族
C. e2g2中即含有离子键有含有非极性共价键
D. 同浓度简单氢化物水溶液的pH值 h >g> z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( ) 
A.发生银镜反应
B.与NaOH水溶液反应
C.催化剂作用下与H2反应
D.与乙酸发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com