
����Ŀ��ij��A0.2mol����������ȫȼ�պ�����![]() ��
��![]() ��1.2mol���ش��������⣺
��1.2mol���ش��������⣺
(1)��A�ķ���ʽΪ______��
(2)����A����ʹ��ˮ��ɫ������һ������������������ȡ����Ӧ��������ȡ����ֻ��һ�֣�����A�Ľṹ��ʽΪ______��
(3)��ȡһ�����ĸ���A��ȫȼ�պ�����![]() ��
��![]() ��3mol������______g��A�μ��˷�Ӧ��ȼ��ʱ���ı�״���µ�����______L��
��3mol������______g��A�μ��˷�Ӧ��ȼ��ʱ���ı�״���µ�����______L��
(4)����A��ʹ��ˮ��ɫ���ڴ��������£���![]() �ӳɣ���ӳɲ��ᆳ�ⶨ�����к���4����������A���ܵĻ�����ʽ��(�����������칹)______��
�ӳɣ���ӳɲ��ᆳ�ⶨ�����к���4����������A���ܵĻ�����ʽ��(�����������칹)______��
���𰸡�![]()
![]() 42 100.8
42 100.8 ![]()
![]()
![]()
��������
(1) 0.2mol CxHy��1.2molCO2+1.2molH2O����ԭ���غ������
(2)A����ʹ��ˮ��ɫ������һ��������������������ȡ����Ӧ����һ�ȴ���ֻ��һ������ֻ��һ��H��Ϊ��������
(3) �ɷ�����ɿ�֪������CO2��H2O��3mol����Ϊ0.75mol����ȷ���������������ĵ�������
(4)����A��ʹ��ˮ��ɫ���ڴ�����������H2�ӳ���������ӳɲ��ᆳ�ⶨ�������к���4������
���ɵ������ṹʽΪ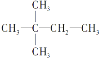 ��
�� ���Դ�ȷ��A�Ľṹ��ʽ��
���Դ�ȷ��A�Ľṹ��ʽ��
(1) 0.2mol��A����������ȫȼ�պ�������CO2��H2O��1.2mol����A�����к���C��Hԭ�����ֱ�Ϊ��N(C)=![]() =6��N(H)=
=6��N(H)=![]() =12��A����ʽΪ��C6H12��
=12��A����ʽΪ��C6H12��
��ˣ�������ȷ������C6H12��
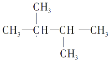
(2) C6H12ֻ��1�������Ͷ�������A����ʹ��ˮ��ɫ������Ϊ������������������������ȡ����Ӧ����һ�ȴ���ֻ��һ����˵���������ֻ��1�ֵ�ЧH���ʸ��л����ǻ��������ṹ��ʽΪ��![]() ��
��
��ˣ�������ȷ������![]() ��
��
(3) ��ȡһ�����ĸ���A��ȫȼ�պ�����CO2��H2O��3mol���ɷ�����ɿ�֪��Ϊ0.75mol������Ϊ0.75mol��56g/mol=42g��
�������������ʵ���Ϊ0.75mol����4+![]() ��=4.5mol��
��=4.5mol��
���Ϊ4.5mol��22.4L/mol=100.8L��
��ˣ�������ȷ������42��100.8��
(4)����A��ʹ��ˮ��ɫ���ڴ�����������H2�ӳ���������ӳɲ��ᆳ�ⶨ�����к���4������˵�����к���C=C�����к���4��������3������̼�ܽṹΪ(�٢ڢ۴��ɷֱ�ͬʱ����˫��)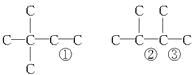 �������еĽṹ��ʽΪ��(CH3)3CCH=CH2
�������еĽṹ��ʽΪ��(CH3)3CCH=CH2
CH2=C(CH3)CH(CH3)3 (CH3)3C=C(CH3)2 ��
��ˣ�������ȷ������(CH3)3CCH=CH2 CH2=C(CH3)CH(CH3)3 (CH3)3C=C(CH3)2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.02mol��L��1��HCN��Һ��0.02mol��L��1��NaCN��Һ�������ϣ���֪�����Һ��C(CN-)��C(Na��)�������й�ϵ�У���ȷ���ǣ�
A��C(Na��)��C(CN-)��C( H��)��C(OH-)
B��C(HCN)+C (CN-)=0.04mol��L-1
C��C(CN-)��C(HCN)
D��C(Na��)+C(H��)= C(CN-)+C(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����桢�㽶��ˮ���д�����������������ʵ�����Ʊ������������ķ�Ӧ��װ��ʾ��ͼ���й��������£�
![]()

ˮ���ܽ��� | �ܶ�(g��cm-3) | �е� | ��Է������� | |
���� | ����ˮ | 1.049 2 | 118 | 60 |
������ | ����ˮ | 0.809 8 | 117.7 | 74 |
���������� | ����ˮ | 0.882 4 | 126.5 | 116 |
ʵ�鲽��:
��.�������������Ʊ�
��A�м���7.4 g��������6.0 g���ᣬ�ټ�������Ũ���ᣬҡ�ȣ�����1~2�ŷ�ʯ����ͼ��װ����ˮ���Ļ�����Ӧװ�ã����ڷ�ˮ����Ԥ�ȼ���ˮ��ʹˮ���Ե��ڷ�ˮ����֧�ܿڣ�ͨ������ˮ����������A���ڷ�Ӧ�����У�ͨ����ˮ���²��������ֳ����ɵ�ˮ�����ַ�ˮ����ˮ��Һ��ĸ߶Ȳ��䣬ʹ�Ͳ㾡���ص�Բ����ƿ�С���Ӧ�ﵽ�յ��ֹͣ���ȣ���¼�ֳ�ˮ�������
��.��Ʒ�ľ���
�ѷ�ˮ���е������A�з�ӦҺ�����Һ©���У��ֱ�������ˮ������̼������Һ��ˮϴ�ӣ��ֳ��IJ������������ˮ����þ���壬���ú���ˣ������ﳣѹ�����ռ�124-126 �����֣��õ�5.8 g��Ʒ����ش��������⣺
(1)��ˮӦ�������ܵ�________(�a����b��)��ͨ�롣
(2)��Ʒ�ľ��ƹ����У���һ��ˮϴ��Ŀ����________________���ڶ���ˮϴ��Ŀ����________________��ϴ����ɺ��л���ӷ�Һ©����________(��Ͽڡ����¿ڡ�)ת�Ƶ���ƿ�С�
(3)��ʵ����߲�Ʒ���ʵķ�����_________________________________________��
(4)�жϷ�Ӧ�յ��������_______________________________________________��
(5)��ʵ������У����������������IJ�����_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��װ�üס��ҡ�����������ˮ������Ӧ��ʵ��װ�ã�����˵������ȷ����
װ�ü� װ����
װ����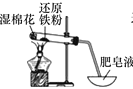 װ�ñ�
װ�ñ�
A.ѡ�ñ�װ�ã�ʵ�����ʱ����ȥ�ƾ��ƣ��ٽ��������ó�ˮ��
B.��װ�����Ȼ��Ƶ������dz�ȥ�����л��е�ˮ����
C.����װ��ʵ��ʱ���������в������������ݣ���ȼ�����ݷ���������
D.����װ����Ƚϣ���װ�ü�������㡢��Լԭ�ϡ���ȫ�Ժ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������װ������ʢ�е���Һ�����Ϊ200ml��Ũ�Ⱦ�Ϊ0.6mol/L������һ��ʱ���õ����Ͼ�ͨ����0.2mol���ӣ���ʱ��Һ�е�![]() �ɴ�С��˳����
�ɴ�С��˳����

������ͭ��Һ ��ϡ���� ���Ȼ�п��Һ ��ʳ��ˮ
A. �ܢڢ٢� B. �ܢۢ٢� C. �ܢۢڢ� D. �٢ۢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ�������ȡ���������ͼ��
![]()
���в���װ�ò�����Ҫ�����
A.  B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaN3)��һ����ɫ���壬�㷺����������ȫ���Ҽ������ϳɵȣ������������Ʊ�����Ϊ��
2NaNH2+N2O�TNaN3+NaOH+NH3��
3NaNH2+NaNO3�TNaN3+3NaOH+NH3��
(1)�ٵ�ԭ�ӵ�L������Ų�ͼ_____________________��
�ڵ����ڵ������У���һ����������Ԫ��Ϊ_____________����Ԫ�ط��ţ���
����N3��Ϊ�ȵ����������Ϊ____________��д��һ�֣���
�ܰ����ĵ���ʽ____________��
(2)NH3�е㣨��33.34�棩��N2O�е㣨��88.49�棩�ߣ�����Ҫԭ����____________
(3)���ݼ۲���ӶԻ������ۣ�NO3-�乹�ͳ�__________����
(4)������ȫ���ҵ�����ǻ��ڷ�Ӧ6NaN3+Fe2O3�T3Na2O+2Fe+9N2�����������е�����һ�ֳ������ʣ������ľ��������ֶѻ���ʽ���������ֵĶѻ���ʽ��ͼ��ʾ�������й����������˵������ȷ����_________��
A���������ĵ�����������ͨ��ʱ���������ɵ����������ƶ�
B������Fe���é�Fe�Ķѻ���ʽ�ֱ���غ�ͭ��ͬ
C���ռ�����������Fe�����é�Fe
D���������ڲ����ڽ�����
(5)�����������־��壨����Fe���é�Fe�����ܶȱ�ֵΪ___________����д��С��������2λ��Ч���֣�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�����������Ƥ��Tϸ���ܰ�����ҩ���ṹ��ͼ��ʾ�������й�˵����ȷ����

A. ����������̼ԭ����ͬһƽ����
B. ���ܷ����ӳɷ�Ӧ�����ܷ�����ȥ��Ӧ
C. ��ʹ��ˮ�����Ը��������Һ��ɫ����ԭ����ͬ
D. 1mol�������ֱ���������Na�� NaHCO3��Ӧ��������������ʵ���֮��Ϊl�U2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��TiCl4����ˮ�����ȣ��õ�����TiO2��xH2O���������տɵõ�TiO2
B. �ɲ�ȡ���������ķ���ʹFeCl3��ˮ��Һ�нᾧ����
C. ����FeCl3��Һʱ��Ϊ�˷�ֹ��Һ���ֻ��ǣ���������Һ�е�����������
D. Ϊ�˳�ȥMgCl2������Һ�е�FeCl3�����ڼ��Ƚ���������¼���MgCO3�����˺�������Һ�м�����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com