
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.用惰性电极电解氯化镁溶液时总反应为:2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.铅蓄电池充电时阳极反应式为:PbSO4-2e-+2H2O=PbO2+4H++SO42-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.NH4Cl溶液显酸性:NH4++2H2O=NH3·H2O+H3O+
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
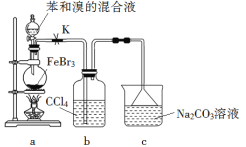
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
①常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA;
②标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA;
③常温下46gNO2和N2O4混合气体中含有原子数为3NA;
④常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA;
⑤足量铁在氯气中反应,lmol铁失去的电子数为2NA;
⑥标准状况下22.4LH2中含中子数为2NA;
⑦1LImol/L的盐酸溶液中,所含氯化氢分子数为NA。
A.①④B.②⑤⑥C.③D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种流程如下:

请回答下列问题:
(1)给滤液E中通入过量的NH3,其反应的离子方程式是____________________。
(2)流程Ⅱ中加入烧碱溶液后,生成SiO![]() 的离子方程式是__________________。
的离子方程式是__________________。
(3)验证滤液A中含Fe3+,可取少量滤液并加入______________(填写试剂名称)。
(4)滤液C中溶质的主要成分是___________(填化学式)。
(5)滤液F中离子电荷守恒的关系式为___________________________。
(6)滤液C和滤液F共同的溶质为G,用惰性电极电解500mL 0.1 mol·L-1的G溶液,若阳极得56 mL气体(标准状况),则所得溶液在常温下pH为_____________(忽略电解前后溶液体积的变化)。
(7)已知25 ℃时Mg(OH)2的溶度积常数Ksp=1.8×10-11。取适量的滤液A,加入一定量的烧碱溶液至达到沉淀溶解平衡,测得该溶液的pH=13.00,则25℃时残留在溶液中的c(Mg2+)=________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g) ![]() 2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:

(1)上图中属于氢气物质的量随时间变化的曲线是_____________(填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是______。
A.t2时该反应达到平衡状态 b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2 D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时五种物质的溶度积常数,下列有关说法错误的是
化学式 |
|
| CuS |
|
|
溶度积 |
|
|
|
|
|
A.根据表中数据可推知,常温下![]() 在纯水中的溶解度比
在纯水中的溶解度比![]() 的大
的大
B.向![]() 溶液中通入
溶液中通入![]() 可生成CuS沉淀,是因为
可生成CuS沉淀,是因为![]()
C.根据表中数据可推知,向硫酸钡沉淀中加入饱和碳酸钠溶液,不可能有碳酸钡生成
D.常温下,![]() 在
在![]() 溶液中比在
溶液中比在![]() 溶液中的溶解度小
溶液中的溶解度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。工业上用软锰矿(主要成分是MnO2·MnO,含有少量Fe2O3、Al2O3、SiO2)制备碳酸锰的流程如下:
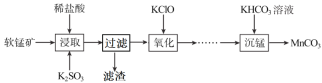
(1)“浸取”步骤中,MnO2·MnO发生反应的离子方程式为___,还能被K2SO3还原的物质有___(填化学式)。“过滤”时滤渣的主要成分是___。
(2)如表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液离子浓度低于1.0×10-5mol·L-1),请补充完整由“氧化”后的溶液制备MnCO3的实验方案:向“氧化”后的溶液中加入____,调pH为___,___,得较纯MnCl2溶液,加入KHCO3溶液沉锰得MnCO3。(实验中可能用到的试剂为K2CO3溶液、盐酸)。
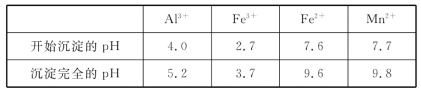
(3)“沉锰”步骤的离子方程式为___,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___。
(4)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:Mn2++S2O82-+H2O---H++SO42-+MnO4-
①请配平上述离子方程式___;
②确认Mn2+离子已经完全反应的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=lgc(Ag+),Ksp(AgCl)=1×1012。如图是向10mLAgNO3溶液中逐渐加入0.1 mol·L1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
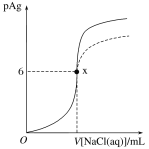
A.原AgNO3溶液的物质的量浓度为0.1mol·L1
B.图中x点的坐标为(100,6)
C.图中x点表示溶液中Ag+被恰好完全沉淀
D.把0.1 mol·L1的NaCl换成0.1mol·L1 NaI则图像在终点后变为虚线部分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com