
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种流程如下:

请回答下列问题:
(1)给滤液E中通入过量的NH3,其反应的离子方程式是____________________。
(2)流程Ⅱ中加入烧碱溶液后,生成SiO![]() 的离子方程式是__________________。
的离子方程式是__________________。
(3)验证滤液A中含Fe3+,可取少量滤液并加入______________(填写试剂名称)。
(4)滤液C中溶质的主要成分是___________(填化学式)。
(5)滤液F中离子电荷守恒的关系式为___________________________。
(6)滤液C和滤液F共同的溶质为G,用惰性电极电解500mL 0.1 mol·L-1的G溶液,若阳极得56 mL气体(标准状况),则所得溶液在常温下pH为_____________(忽略电解前后溶液体积的变化)。
(7)已知25 ℃时Mg(OH)2的溶度积常数Ksp=1.8×10-11。取适量的滤液A,加入一定量的烧碱溶液至达到沉淀溶解平衡,测得该溶液的pH=13.00,则25℃时残留在溶液中的c(Mg2+)=________ mol·L-1。
【答案】Al2O3+6H+===2Al3++3H2O,Al3++3NH3·H2O===Al(OH)3↓+3NH4+ SiO2+2OH-===SiO32-+H2O 硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案) NaCl、NaHCO3 c(NH4+)+ c(Na+)+ c(H+)= c(OH-)+ c(Cl-) 12 1.8×10-9
【解析】
Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,生成NaAlO2和Na2SiO3在D溶液中,过滤残渣D是不与NaOH溶液反应的MgO、Fe2O3;NaAlO2和Na2SiO3的溶液,加入盐酸,溶液E中有AlCl3、NaCl和HCl溶质,滤去的固体E是H2SiO3;溶液E中通入NH3,固体F是Al(OH)3,灼烧后为氧化铝,溶液F含NaCl和NH4Cl。
铝土矿中除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应,故A溶液中有AlCl3、FeCl3、MgCl2和HCl;在加入过量烧碱,生成沉淀B是Fe(OH)3和Mg(OH)2,溶液B中有NaAlO2和NaOH;溶液B中通入过量CO2,溶液C是NaCl和NaHCO3两种溶质,产生C沉淀是Al(OH)3;Al(OH)3灼烧生成Al2O3,据以上分析解答。
Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,生成NaAlO2和Na2SiO3在D溶液中,过滤残渣D是不与NaOH溶液反应的MgO、Fe2O3;NaAlO2和Na2SiO3的溶液,加入盐酸,溶液E中有AlCl3、NaCl和HCl溶质,滤去的固体E是H2SiO3;溶液E中通入NH3,固体F是Al(OH)3,溶液F含NaCl和NH4Cl;
铝土矿中除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应,故A溶液中有AlCl3、FeCl3、MgCl2和HCl;在加入过量烧碱,生成沉淀B是Fe(OH)3和Mg(OH)2,溶液B中有NaAlO2和NaOH;溶液B中通入过量CO2,溶液C是NaCl和NaHCO3两种溶质,产生C沉淀是Al(OH)3;Al(OH)3灼烧生成Al2O3;
(1)给滤液E中通入过量的NH3,其反应的离子方程式是Al2O3+6H+===2Al3++3H2O,Al3++3NH3·H2O===Al(OH)3↓+3NH4+;
(2)流程Ⅱ中加入烧碱溶液后,生成SiO![]() 的离子方程式是SiO2+2OH-===SiO32-+H2O;
的离子方程式是SiO2+2OH-===SiO32-+H2O;
(3)验证滤液A中含Fe3+,可取少量滤液并加入硫氰化钾或硫氰酸钾或苯酚溶液等;
(4)滤液C中溶质的主要成分是NaCl、NaHCO3;
(5)滤液F(NaCl和NH4Cl)中离子电荷守恒的关系式为c(NH4+)+ c(Na+)+ c(H+)= c(OH-)+ c(Cl-);
(6)滤液C和滤液F共同的溶质为NaCl,用惰性电极电解500mL 0.1 mol·L-1的NaCl溶液,阳极得56 mL气体Cl2(标准状况);2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH,n(NaOH)=2n(Cl2)=
H2↑+Cl2↑+2NaOH,n(NaOH)=2n(Cl2)= ![]() =0.005mol,溶液中故c(NaOH)=0.01mol/L,pOH=2,pH=12;
=0.005mol,溶液中故c(NaOH)=0.01mol/L,pOH=2,pH=12;
(7) pH=13.00时,c(OH-)=0.1 mol·L-1,Ksp=c(Mg2+)·c2(OH-)=1.8×10-11,可得c(Mg2+)=1.8×10-9mol·L-1。


科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关氢氧燃料电池的说法正确的是( )

A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.用排饱和食盐水的方法收集氯气
B.500℃左右比室温更有利于工业合成NH3的反应
C.加入催化剂有利于SO2的氧化反应
D.对2HI(g)![]() H2(g) + I2(g),减小容器体积,气体颜色变深
H2(g) + I2(g),减小容器体积,气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:乙![]() 丙
丙![]() 丁
丁
B.单质的还原性:丁![]() 丙
丙![]() 甲
甲
C.乙、丙、丁的最髙价氧化物对应的水化物能相互反应
D.甲、乙、丙的氧化物均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究酸雨对低碳钢腐蚀的影响,实验流程如图:

实验使用了3种模拟酸雨。模拟酸雨中的离子浓度如表所示,其中平衡电荷的阳离子以NH![]() 或Na+补充,实验均在室温下进行,低碳钢片样品的大小和质量均相同。
或Na+补充,实验均在室温下进行,低碳钢片样品的大小和质量均相同。

(1)将模拟酸雨1和模拟酸雨2进行对比实验,实验的目的是___。模拟酸雨3对钢片的腐蚀速率大于模拟酸雨2对钢片的腐蚀速率,可以得到结论是___。
(2)在用模拟酸雨2进行实验时,腐蚀冲洗液中检测到Fe2+和NH![]() 的含量升高。腐蚀时硝酸和铁反应的离子方程式为___。
的含量升高。腐蚀时硝酸和铁反应的离子方程式为___。
(3)在上述三组腐蚀实验中,都检测到钢片内部持续产生腐蚀电流。产生腐蚀电流的原因是___。
(4)钢铁的腐蚀研究中,通常用“腐蚀速率(单位为mg·h-1)"对钢铁腐蚀过程和结果进行评估。则计算“腐蚀速率”需要测量的实验数据为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属钠和镁等,其流程如图所示。
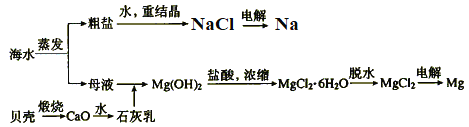
下列说法正确的是
A. 电解NaCl溶液可得到金属钠
B. 上述过程中发生了分解、化合、置换、复分解反应
C. 上述流程中生成Mg(OH)2沉淀的离子方程式为Mg2++2OH-=Mg(OH)2↓
D. 不用电解MgO来制取镁是因为MgO的熔点比MgCl2的高,能耗大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.用惰性电极电解氯化镁溶液时总反应为:2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.铅蓄电池充电时阳极反应式为:PbSO4-2e-+2H2O=PbO2+4H++SO42-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.NH4Cl溶液显酸性:NH4++2H2O=NH3·H2O+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述不正确的是( )
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |

A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH =11的NH3H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05molL-1
C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
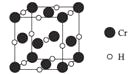
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com