
【题目】短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:乙![]() 丙
丙![]() 丁
丁
B.单质的还原性:丁![]() 丙
丙![]() 甲
甲
C.乙、丙、丁的最髙价氧化物对应的水化物能相互反应
D.甲、乙、丙的氧化物均为共价化合物
【答案】C
【解析】
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,则甲为H,乙位于第VA族,乙为N;甲和丙同主族,丙为Na;丁的最外层电子数和电子层数相等,则丁在第三周期第ⅢA族,即丁为Al。
A.同周期自左而右原子半径减小、同主族自上而下原子半径越大,则原子半径:丙![]() 丁
丁![]() 乙,故A错误;
乙,故A错误;
B.金属性越强,单质的还原性越强,则单质的还原性:丙![]() 丁
丁![]() 甲,故B错误;
甲,故B错误;
C.乙、丙、丁的最高价氧化物对应的水化物分别为硝酸、氢氧化钠、氢氧化铝,氢氧化铝为两性氢氧化物,能硝酸、氢氧化钠反应,硝酸与氢氧化钠发生中和反应,故C正确;
D.甲、乙的氧化物为共价化合物,丙的氧化物为离子化合物,故D错误.
答案选C。


科目:高中化学 来源: 题型:
【题目】研究表明金属铁能与N2O、CO反应,其反应的能量变化与反应进程如图所示,下列说法不正确的是( )
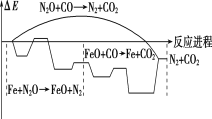
A.总反应为放热反应
B.加入铁,可使反应的焓变减小
C.Fe是该反应的催化剂
D.Fe+N2O→FeO+N2,FeO+CO→Fe+CO2两步反应均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝在生产、生活中应用广泛。工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
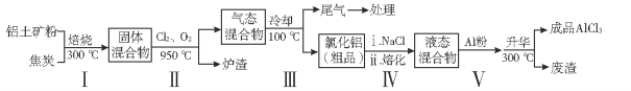
已知:
物质 |
|
|
|
|
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
回答下列问题:
(1)步骤I中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)请写出步骤I中反应的方程式:________________________、______________________
(3)步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为____________________。
(4)氯化铝粗品中的杂质主要是___________(写化学式)。结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)俗称海波、大苏打,无色透明晶体,易溶于水,遇强酸反应产生硫单质和二氧化硫气体;具有强还原性,与强氧化剂反应产物为SO42-;
(1)Na2S2O3中S元素的化合价为_________。
(2)向Na2S2O3溶液中滴加稀硫酸,其反应的离子方程式为____________________________。
(3)Na2S2O3溶液与Cl2反应,可作为绵织物漂白后的脱氧剂。该反应的离子方程式为_______,要脱去22.4 L Cl2(标准状况下),需要Na2S2O3________mol。
(4)工业上常用硫化碱法制备海波。其原理是向碳酸钠和硫化钠物质的量之比为1:2的混合液中通入过量的二氧化硫,经蒸发、结晶,即得硫代硫酸钠。其反应的化学方程式为_____,其氧化剂为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
①常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA;
②标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA;
③常温下46gNO2和N2O4混合气体中含有原子数为3NA;
④常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA;
⑤足量铁在氯气中反应,lmol铁失去的电子数为2NA;
⑥标准状况下22.4LH2中含中子数为2NA;
⑦1LImol/L的盐酸溶液中,所含氯化氢分子数为NA。
A.①④B.②⑤⑥C.③D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.请回答下列问题:
(1)TiCl4水解生成TiO2x H2O的化学方程式为____________________________________.
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是__________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的______(填字母代号)

(3)滴定分析时,称取TiO2(摩尔质量为M gmol-1)试样w g,消耗c molL-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为______.
(4)判断下列操作对TiO2质量分数测定结果的影响(填 “偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果______.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种流程如下:

请回答下列问题:
(1)给滤液E中通入过量的NH3,其反应的离子方程式是____________________。
(2)流程Ⅱ中加入烧碱溶液后,生成SiO![]() 的离子方程式是__________________。
的离子方程式是__________________。
(3)验证滤液A中含Fe3+,可取少量滤液并加入______________(填写试剂名称)。
(4)滤液C中溶质的主要成分是___________(填化学式)。
(5)滤液F中离子电荷守恒的关系式为___________________________。
(6)滤液C和滤液F共同的溶质为G,用惰性电极电解500mL 0.1 mol·L-1的G溶液,若阳极得56 mL气体(标准状况),则所得溶液在常温下pH为_____________(忽略电解前后溶液体积的变化)。
(7)已知25 ℃时Mg(OH)2的溶度积常数Ksp=1.8×10-11。取适量的滤液A,加入一定量的烧碱溶液至达到沉淀溶解平衡,测得该溶液的pH=13.00,则25℃时残留在溶液中的c(Mg2+)=________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时五种物质的溶度积常数,下列有关说法错误的是
化学式 |
|
| CuS |
|
|
溶度积 |
|
|
|
|
|
A.根据表中数据可推知,常温下![]() 在纯水中的溶解度比
在纯水中的溶解度比![]() 的大
的大
B.向![]() 溶液中通入
溶液中通入![]() 可生成CuS沉淀,是因为
可生成CuS沉淀,是因为![]()
C.根据表中数据可推知,向硫酸钡沉淀中加入饱和碳酸钠溶液,不可能有碳酸钡生成
D.常温下,![]() 在
在![]() 溶液中比在
溶液中比在![]() 溶液中的溶解度小
溶液中的溶解度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出氯原子的原子结构示意图____________,NH4Cl的电子式_______________;
(2)用电子式表示H2O的形成过程_________________________________________________;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量___(填“高”、“低”),故白磷比红磷稳定性_____(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,______放出热量多。
(4)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 ____。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
(5)电解法冶炼金属铝的化学方程式为_____________。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为________________,引发铝热反应的实验操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com