
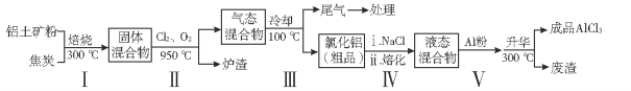
【题目】无水氯化铝在生产、生活中应用广泛。工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
物质 |
|
|
|
|
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
回答下列问题:
(1)步骤I中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)请写出步骤I中反应的方程式:________________________、______________________
(3)步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为____________________。
(4)氯化铝粗品中的杂质主要是___________(写化学式)。结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_____________________________。
【答案】增大反应物的接触面积,加快反应速率(或防止后续步骤生成的AlCl3水解) Fe2O3+3C![]() 2Fe+3CO↑ SiO2+2C
2Fe+3CO↑ SiO2+2C![]() Si+2CO↑ NaCl、NaClO、Na2CO3 FeCl3 除去FeCl3提高AlCl3纯度
Si+2CO↑ NaCl、NaClO、Na2CO3 FeCl3 除去FeCl3提高AlCl3纯度
【解析】
用铝土矿制取无水氯化铝工艺流程:铝土矿粉和焦炭在300℃焙烧,Fe2O3和SiO2被焦炭还原为Fe、Si,该过程生成CO,固体混合物和氯气、氧气在950℃加热,和Cl2反应生成对应的氯化物,即SiCl4、AlCl3、FeCl3,CO和O2反应生成CO2,后冷却到100℃,尾气为CO2、多余的Cl2、O2以及SiCl4,AlCl3和FeCl3变成固体,得到氯化铝的粗品,加入氯化钠熔融,铝的金属活动性强于铁,加铝粉,可以将氯化铝的粗品中的氯化铁中的铁置换出来,生成铁和氯化铝,在300℃,氯化铝升华,废渣为Fe,得到成品氯化铝,以此解答该题。
(1)步骤1中铝土矿粉和焦炭在300℃焙烧,因后续步骤反应生成氯化铝等强酸弱碱盐易水解,固体水分在焙烧的过程中挥发,防止后续步骤生成的盐水解、气孔数目增多增大反应物的接触面积,加快反应速率;
(2)根据分析,步骤I为Fe2O3和SiO2被焦炭还原为Fe、Si,反应的方程式:Fe2O3+3C![]() 2Fe+3CO↑、SiO2+2C
2Fe+3CO↑、SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(3)根据分析,步骤Ⅲ的尾气为CO2、多余的Cl2、O2以及SiCl4,SiCl4的沸点为57.6℃,经冷却至室温后,气体为CO2、多余的Cl2、O2,用足量的NaOH冷溶液吸收,Cl2和NaOH溶液反应生成NaCl、NaClO和H2O,CO2和NaOH溶液反应生成Na2CO3和H2O,所以生成的盐的化学式为NaCl、NaClO和Na2CO3;
(4)根据分析,氯化铝粗品中的杂质主要是FeCl3;结合流程及相关数据分析,步骤Ⅴ中加入铝粉可以将氯化铝的粗品中的氯化铁中的铁置换出来,生成铁和氯化铝,因AlCl3在180℃升华,在300℃,废渣为Fe,冷却得到成品氯化铝,则目的是除去FeCl3,提高AlCl3纯度。


科目:高中化学 来源: 题型:
【题目】双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是

A. 双酚A的分子式是C15H16O2
B. 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
C. 反应①中,1 mol双酚A最多消耗2 mol Br2
D. 反应②的产物中只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关氢氧燃料电池的说法正确的是( )

A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
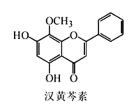
A.汉黄芩素的分子式为C16H13O5
B.该物质能与Na2CO3溶液反应,遇FeCl3溶液显色
C.1mol该物质与溴水反应最多可与2molBr2发生加成反应
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)![]() N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:
N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:

下列说法正确的是
A.组别①中0 ~20 min内,NO2降解速率为0.0125molL-1min-1
B.由实验数据可知温度T1<T2
C.40min时,表格中M对应的数据为0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验现象所进行的解释不合理的是( )
选项 | 现象和事实 | 解释 |
A | 乙烯通入溴的四氯化碳溶液,溴的四氯化碳溶液橙红色褪色 | 乙烯和四氯化碳溶液中的溴发生加成反应,生成无色的1,2-二溴乙烷 |
B | 海轮船壳外侧焊接大量锌块,能有效减缓钢铁船壳在海水中的腐蚀速率 | 锌和铁在海水中构成原电池,锌作负极提供电子,从而保护了钢铁 |
C | 将大理石颗粒加入盐酸中,反应生成气体的速率先逐渐加快后逐渐减慢 | 开始阶段反应放热,溶液温度升高;后期反应吸热,溶液温度下降 |
D | 在AgNO3溶液中加入过量NaCl溶液,静置后,在上层清液中仍检测到Ag+ | Ag+和Cl-的沉淀反应为可逆反应,受反应限度制约,Ag+不能完全沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.用排饱和食盐水的方法收集氯气
B.500℃左右比室温更有利于工业合成NH3的反应
C.加入催化剂有利于SO2的氧化反应
D.对2HI(g)![]() H2(g) + I2(g),减小容器体积,气体颜色变深
H2(g) + I2(g),减小容器体积,气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:乙![]() 丙
丙![]() 丁
丁
B.单质的还原性:丁![]() 丙
丙![]() 甲
甲
C.乙、丙、丁的最髙价氧化物对应的水化物能相互反应
D.甲、乙、丙的氧化物均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述不正确的是( )
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |

A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH =11的NH3H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05molL-1
C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com