
【题目】关于下列各图的叙述不正确的是( )
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |

A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH =11的NH3H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05molL-1
C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
【答案】C
【解析】
A. CO的燃烧热283kJ·mol-1,热化学方程式为:CO(g) + ![]() O2(g) = CO2(g) ΔH = -283 kJ·mol-1;O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1;依据盖斯定律第一个方程减去第二个方程的一半得到CO(g) + H2O(g) = CO2(g) + H2(g) ΔH = -41.2 kJ·mol-1,与图象符合,故A正确;
O2(g) = CO2(g) ΔH = -283 kJ·mol-1;O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1;依据盖斯定律第一个方程减去第二个方程的一半得到CO(g) + H2O(g) = CO2(g) + H2(g) ΔH = -41.2 kJ·mol-1,与图象符合,故A正确;
B. 某温度下,pH =11的NH3H2O氢氧根离子浓度为0.001 molL-1,和pH =1的盐酸溶液中氢离子浓度为0.1 molL-1;等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应生成氯化铵浓度为0.05 molL-1;依据物料守恒,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05 molL-1,故B正确;
C. K值越大,说明反应的正向程度越大,即转化率越高;反应的正向程度越小,说明生成物越不稳定,越易分解,反应程度越小,但不能判断与氢气反应的剧烈程度,故C错误;
D. 常温下向弱酸HA的稀溶液中加水稀释过程中,弱酸电离被促进,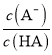 比值增大,符合图象分析,故D正确;
比值增大,符合图象分析,故D正确;
综上所述,答案为C。


科目:高中化学 来源: 题型:
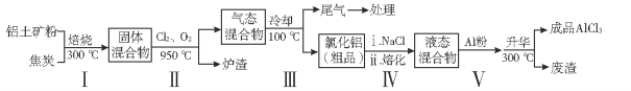
【题目】无水氯化铝在生产、生活中应用广泛。工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
物质 |
|
|
|
|
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
回答下列问题:
(1)步骤I中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)请写出步骤I中反应的方程式:________________________、______________________
(3)步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为____________________。
(4)氯化铝粗品中的杂质主要是___________(写化学式)。结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种流程如下:

请回答下列问题:
(1)给滤液E中通入过量的NH3,其反应的离子方程式是____________________。
(2)流程Ⅱ中加入烧碱溶液后,生成SiO![]() 的离子方程式是__________________。
的离子方程式是__________________。
(3)验证滤液A中含Fe3+,可取少量滤液并加入______________(填写试剂名称)。
(4)滤液C中溶质的主要成分是___________(填化学式)。
(5)滤液F中离子电荷守恒的关系式为___________________________。
(6)滤液C和滤液F共同的溶质为G,用惰性电极电解500mL 0.1 mol·L-1的G溶液,若阳极得56 mL气体(标准状况),则所得溶液在常温下pH为_____________(忽略电解前后溶液体积的变化)。
(7)已知25 ℃时Mg(OH)2的溶度积常数Ksp=1.8×10-11。取适量的滤液A,加入一定量的烧碱溶液至达到沉淀溶解平衡,测得该溶液的pH=13.00,则25℃时残留在溶液中的c(Mg2+)=________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时五种物质的溶度积常数,下列有关说法错误的是
化学式 |
|
| CuS |
|
|
溶度积 |
|
|
|
|
|
A.根据表中数据可推知,常温下![]() 在纯水中的溶解度比
在纯水中的溶解度比![]() 的大
的大
B.向![]() 溶液中通入
溶液中通入![]() 可生成CuS沉淀,是因为
可生成CuS沉淀,是因为![]()
C.根据表中数据可推知,向硫酸钡沉淀中加入饱和碳酸钠溶液,不可能有碳酸钡生成
D.常温下,![]() 在
在![]() 溶液中比在
溶液中比在![]() 溶液中的溶解度小
溶液中的溶解度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) ![]() CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中相对位置如图所示。Z和Y两元素可以形成常见ZY3型化合物,下列说法正确的是

A. X的常见氢化物比Y的常见氢化物稳定
B. X、Z、W的氧化物对应水化物都是常见的强酸
C. W单质不能从盐溶液中置换出Z单质
D. X、Z均可与Y形成原子个数比为1:2的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。工业上用软锰矿(主要成分是MnO2·MnO,含有少量Fe2O3、Al2O3、SiO2)制备碳酸锰的流程如下:
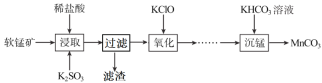
(1)“浸取”步骤中,MnO2·MnO发生反应的离子方程式为___,还能被K2SO3还原的物质有___(填化学式)。“过滤”时滤渣的主要成分是___。
(2)如表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液离子浓度低于1.0×10-5mol·L-1),请补充完整由“氧化”后的溶液制备MnCO3的实验方案:向“氧化”后的溶液中加入____,调pH为___,___,得较纯MnCl2溶液,加入KHCO3溶液沉锰得MnCO3。(实验中可能用到的试剂为K2CO3溶液、盐酸)。
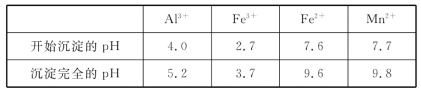
(3)“沉锰”步骤的离子方程式为___,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___。
(4)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:Mn2++S2O82-+H2O---H++SO42-+MnO4-
①请配平上述离子方程式___;
②确认Mn2+离子已经完全反应的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出氯原子的原子结构示意图____________,NH4Cl的电子式_______________;
(2)用电子式表示H2O的形成过程_________________________________________________;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量___(填“高”、“低”),故白磷比红磷稳定性_____(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,______放出热量多。
(4)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 ____。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
(5)电解法冶炼金属铝的化学方程式为_____________。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为________________,引发铝热反应的实验操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
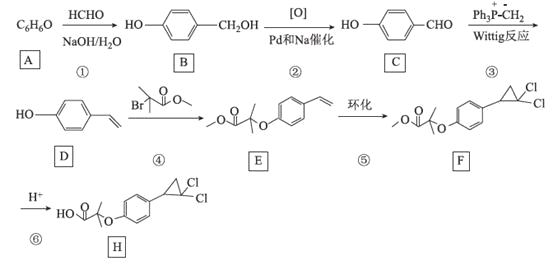
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com