
【题目】硫代硫酸钠(Na2S2O3)俗称海波、大苏打,无色透明晶体,易溶于水,遇强酸反应产生硫单质和二氧化硫气体;具有强还原性,与强氧化剂反应产物为SO42-;
(1)Na2S2O3中S元素的化合价为_________。
(2)向Na2S2O3溶液中滴加稀硫酸,其反应的离子方程式为____________________________。
(3)Na2S2O3溶液与Cl2反应,可作为绵织物漂白后的脱氧剂。该反应的离子方程式为_______,要脱去22.4 L Cl2(标准状况下),需要Na2S2O3________mol。
(4)工业上常用硫化碱法制备海波。其原理是向碳酸钠和硫化钠物质的量之比为1:2的混合液中通入过量的二氧化硫,经蒸发、结晶,即得硫代硫酸钠。其反应的化学方程式为_____,其氧化剂为_____________。
【答案】+2 2H++S2O32﹣═SO2↑+S↓+H2O 4Cl2+S2O32﹣+5H2O=2SO42﹣+10H++8Cl﹣ 0.25 2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 SO2
【解析】
(1)根据化合价代数和为0计算Na2S2O3中S元素的化合价;
(2)酸性条件下Na2S2O3与氢离子反应生成二氧化硫、硫单质和水;
(3)Na2S2O3溶液与Cl2反应,可作为绵织物漂白后的脱氯剂,故反应方程式为Na2S2O3+4Cl2+5H2O═2NaCl+2H2SO4+6HCl,据此书写离子方程式;依据化学方程式定量关系计算Na2S2O3的物质的量;
(4)碳酸钠和硫化钠物质的量之比为1:2的混合液中通入过量的二氧化硫,经蒸发、结晶,即得硫代硫酸钠,据此书写方程式;化合价降低的为氧化剂。
(1)设Na2S2O3中S元素的化合价为x,化合价代数和为0,则2+2x+(﹣2)×3=0,解得x=2,故S元素化合价为+2;
(2)在Na2S2O3溶液中滴加稀硫酸,反应生成二氧化硫气体、硫单质和水,反应的离子方程式为:2H++S2O32﹣═SO2↑+S↓+H2O;
(3)Na2S2O3溶液与Cl2反应,可作为绵织物漂白后的脱氯剂,故反应方程式为Na2S2O3+4Cl2+5H2O═2NaCl+2H2SO4+6HCl,故离子方程式为4Cl2+S2O32﹣+5H2O=2SO42﹣+10H++8Cl﹣;设需要Na2S2O3物质的量为x,反应的氯气物质的量=![]() =1mol,由Na2S2O3+4Cl2+5H2O═2NaCl+2H2SO4+6HCl可知参加反应的Na2S2O3的物质的量为1mol
=1mol,由Na2S2O3+4Cl2+5H2O═2NaCl+2H2SO4+6HCl可知参加反应的Na2S2O3的物质的量为1mol![]() =0.25mol;
=0.25mol;
(4)碳酸钠和硫化钠物质的量之比为1:2的混合液中通入过量的二氧化硫,经蒸发、结晶,即得硫代硫酸钠,故化学方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;化合价降低的为氧化剂,故氧化剂为SO2。


科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
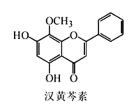
A.汉黄芩素的分子式为C16H13O5
B.该物质能与Na2CO3溶液反应,遇FeCl3溶液显色
C.1mol该物质与溴水反应最多可与2molBr2发生加成反应
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验现象所进行的解释不合理的是( )
选项 | 现象和事实 | 解释 |
A | 乙烯通入溴的四氯化碳溶液,溴的四氯化碳溶液橙红色褪色 | 乙烯和四氯化碳溶液中的溴发生加成反应,生成无色的1,2-二溴乙烷 |
B | 海轮船壳外侧焊接大量锌块,能有效减缓钢铁船壳在海水中的腐蚀速率 | 锌和铁在海水中构成原电池,锌作负极提供电子,从而保护了钢铁 |
C | 将大理石颗粒加入盐酸中,反应生成气体的速率先逐渐加快后逐渐减慢 | 开始阶段反应放热,溶液温度升高;后期反应吸热,溶液温度下降 |
D | 在AgNO3溶液中加入过量NaCl溶液,静置后,在上层清液中仍检测到Ag+ | Ag+和Cl-的沉淀反应为可逆反应,受反应限度制约,Ag+不能完全沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.用排饱和食盐水的方法收集氯气
B.500℃左右比室温更有利于工业合成NH3的反应
C.加入催化剂有利于SO2的氧化反应
D.对2HI(g)![]() H2(g) + I2(g),减小容器体积,气体颜色变深
H2(g) + I2(g),减小容器体积,气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:

①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:乙![]() 丙
丙![]() 丁
丁
B.单质的还原性:丁![]() 丙
丙![]() 甲
甲
C.乙、丙、丁的最髙价氧化物对应的水化物能相互反应
D.甲、乙、丙的氧化物均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属钠和镁等,其流程如图所示。
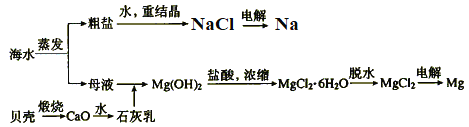
下列说法正确的是
A. 电解NaCl溶液可得到金属钠
B. 上述过程中发生了分解、化合、置换、复分解反应
C. 上述流程中生成Mg(OH)2沉淀的离子方程式为Mg2++2OH-=Mg(OH)2↓
D. 不用电解MgO来制取镁是因为MgO的熔点比MgCl2的高,能耗大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com