
【题目】下列每组两种物质中,都既含离子键又含共价键的是( )
A.SiO2和CO2B.NaOH和CH4C.Na2O2和NH4ClD.NaCl和HCl
【答案】C
【解析】
A.SiO2为共价化合物,只含有共价键,CO2为共价化合物,只含有共价键,故A不符合题意;
B.NaOH为离子化合物,其中Na+与OH-之间通过离子键连接,OH-中O原子与H原子之间通过共价键连接,NaOH中含有离子键、共价键,CH4为共价化合物,只含有共价键,故B不符合题意;
C.Na2O2为离子化合物,其中Na+与![]() 之间通过离子键连接,
之间通过离子键连接,![]() 中O原子通过共价键连接,Na2O2中含有离子键、共价键,NH4Cl为离子化合物,其中
中O原子通过共价键连接,Na2O2中含有离子键、共价键,NH4Cl为离子化合物,其中![]() 与Cl-通过离子键连接,
与Cl-通过离子键连接,![]() 中N原子与H原子之间通过共价键连接,NH4Cl中含有离子键、共价键,故C符合题意;
中N原子与H原子之间通过共价键连接,NH4Cl中含有离子键、共价键,故C符合题意;
D.NaCl为离子化合物,其中只含有离子键,HCl为共价化合物,其中只含有共价键,故D不符合题意;
综上所述,两种物质中,都既含离子键又含共价键的是C,故答案为:C。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)俗称海波、大苏打,无色透明晶体,易溶于水,遇强酸反应产生硫单质和二氧化硫气体;具有强还原性,与强氧化剂反应产物为SO42-;
(1)Na2S2O3中S元素的化合价为_________。
(2)向Na2S2O3溶液中滴加稀硫酸,其反应的离子方程式为____________________________。
(3)Na2S2O3溶液与Cl2反应,可作为绵织物漂白后的脱氧剂。该反应的离子方程式为_______,要脱去22.4 L Cl2(标准状况下),需要Na2S2O3________mol。
(4)工业上常用硫化碱法制备海波。其原理是向碳酸钠和硫化钠物质的量之比为1:2的混合液中通入过量的二氧化硫,经蒸发、结晶,即得硫代硫酸钠。其反应的化学方程式为_____,其氧化剂为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时五种物质的溶度积常数,下列有关说法错误的是
化学式 |
|
| CuS |
|
|
溶度积 |
|
|
|
|
|
A.根据表中数据可推知,常温下![]() 在纯水中的溶解度比
在纯水中的溶解度比![]() 的大
的大
B.向![]() 溶液中通入
溶液中通入![]() 可生成CuS沉淀,是因为
可生成CuS沉淀,是因为![]()
C.根据表中数据可推知,向硫酸钡沉淀中加入饱和碳酸钠溶液,不可能有碳酸钡生成
D.常温下,![]() 在
在![]() 溶液中比在
溶液中比在![]() 溶液中的溶解度小
溶液中的溶解度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中相对位置如图所示。Z和Y两元素可以形成常见ZY3型化合物,下列说法正确的是

A. X的常见氢化物比Y的常见氢化物稳定
B. X、Z、W的氧化物对应水化物都是常见的强酸
C. W单质不能从盐溶液中置换出Z单质
D. X、Z均可与Y形成原子个数比为1:2的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。工业上用软锰矿(主要成分是MnO2·MnO,含有少量Fe2O3、Al2O3、SiO2)制备碳酸锰的流程如下:
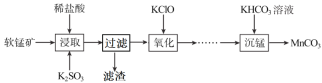
(1)“浸取”步骤中,MnO2·MnO发生反应的离子方程式为___,还能被K2SO3还原的物质有___(填化学式)。“过滤”时滤渣的主要成分是___。
(2)如表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液离子浓度低于1.0×10-5mol·L-1),请补充完整由“氧化”后的溶液制备MnCO3的实验方案:向“氧化”后的溶液中加入____,调pH为___,___,得较纯MnCl2溶液,加入KHCO3溶液沉锰得MnCO3。(实验中可能用到的试剂为K2CO3溶液、盐酸)。
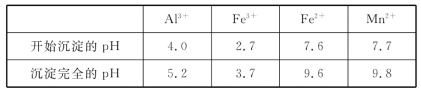
(3)“沉锰”步骤的离子方程式为___,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___。
(4)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:Mn2++S2O82-+H2O---H++SO42-+MnO4-
①请配平上述离子方程式___;
②确认Mn2+离子已经完全反应的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 的
的![]() 溶液滴定
溶液滴定![]()
![]() 的
的![]() 溶液,水的电离程度随
溶液,水的电离程度随![]() 溶液体积的变化曲线如图所示。下列说法正确的是( )
溶液体积的变化曲线如图所示。下列说法正确的是( )

A.该滴定过程应该选择甲基橙作为指示剂
B.从![]() 点到
点到![]() 点,溶液中水的电离程度逐渐增大
点,溶液中水的电离程度逐渐增大
C.![]() 点溶液中
点溶液中![]()
D.![]() 点对应的
点对应的![]() 溶液的体积为
溶液的体积为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出氯原子的原子结构示意图____________,NH4Cl的电子式_______________;
(2)用电子式表示H2O的形成过程_________________________________________________;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量___(填“高”、“低”),故白磷比红磷稳定性_____(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,______放出热量多。
(4)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 ____。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
(5)电解法冶炼金属铝的化学方程式为_____________。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为________________,引发铝热反应的实验操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A.充电时,当阳极质量减少23.9g时转移0.2 mol电子
B.放电时,PbO2电极附近溶液的pH增大
C.电子放电时,负极反应为PbO2+4HBF4-2e-=Pb(BF4)2+2HF4-+2H2O
D.充电时,Pb电极的电极反应式为PbO2+H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生活有着密切的联系。下列有关说法中错误的是
A.硅是优良的半导体材料,可用于制太阳能电池
B.![]() 俗称磁性氧化铁,常用作红色油漆和涂料
俗称磁性氧化铁,常用作红色油漆和涂料
C.燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
D.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com