
下列说法正确的是
A.蒸干碳酸钾溶液得到的固体物质为KOH
B.铁表面镀铜时,铜与电源的负极相连,而铁与电源的正极相连
C.工业合成氨反应温度选择700 K左右,可使催化剂活性最强并提高原料利用率
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=2×283.0kJ/mol
科目:高中化学 来源: 题型:
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是 ( )。
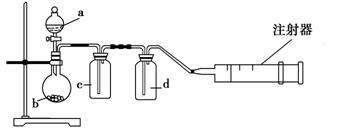
| 选 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y
B.因为酸性H2SO3> H2CO3,所以非金属性S>C
C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D.Ca和Ba分别位于第IIA族第四周期和第六周期,则碱性: Ca(OH)2 <Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
按图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
①③ B.③④ C.①②⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
I.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g) + 2B(s) yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:

(1)用A的浓度变化表示该反应0~10 min内的平均反应速率V(A)=_______。
(2)推测第10 min引起曲线变化的反应条件可能是_____(填序号,下同);第16 min引起曲线变化的反应条件可能是______。
①减压 ②增大A的浓度 ③增大C的量
④升温 ⑤降温 ⑥加入催化剂
(3)若平衡I的平衡常数为K1,平衡II的平衡常数为K2,则K1______K2(填“>”、“=”或“<”)。
II. 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广
泛。铁还有很多的化合物及其化学反应,如铁与水的反应:
3Fe(s) + 4H2O(g) Fe3O4(s) + 4H2(g) △H
Fe3O4(s) + 4H2(g) △H
(1)已知:① 3Fe(s) + 2O2(g) Fe3O4(s) △H1=-1118.4 kJ/mol
Fe3O4(s) △H1=-1118.4 kJ/mol
② 2H2(g) + O2(g) 2H2O(g) △H2=-483.8 kJ/mol
2H2O(g) △H2=-483.8 kJ/mol
③ 2H2(g) + O2(g) 2H2O(l) △H3=-571.8 kJ/mol
2H2O(l) △H3=-571.8 kJ/mol
则△H =____________________(计算结果保留一位小数)。
(2)在t ℃时,该反应的平衡常数K=16,在2 L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,在t ℃时反应经过一段时间后达到平衡。
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中H2O的平衡转化率为____________(结果保留一位小数)
②下列说法正确的是______________(填字母序号)
A. 若容器压强恒定,则反应达到平衡状态
B. 若容器内密度恒定,则反应达到平衡状态
C. 甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D. 增加Fe3O4就能提高H2O的转化率
(3)若将(3)中装置改为恒容绝热(不与外界交换能量)的装置,按下表
充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见下表:
|
| Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的百分含量按由大到小的顺序排列:___________________(用A、B、C表示)。
(4)一种以甲醇做燃料的电池示意图如下图。写出该电池放电时负极的电极反应式:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,对于反应:N2(g)+3H2 2NH3(g),在反应起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%。若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物质的量和NH3的转化率正确的是
2NH3(g),在反应起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%。若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物质的量和NH3的转化率正确的是
A. 20mol;70% B. 20mol;30% C. 40mol;35% D. 10mol;50%
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硫酸生产流程如下图:
|

(1)在沸腾炉中,需要将黄铁矿粉碎的目的是 ▲ 。
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 ▲ 。(填写编号)
a.减少压强 b.升高温度
c.不断补充空气 d.及时分离出SO3
(3)在生产中,为提高催化剂效率采取的措施有 ▲ , ▲ (答出2点)。
(4)在450℃、常压和钒催化条件下,在容积为VL的恒容容器中加入2n molSO2和n molO2
判断反应达到平衡状态的标志是 ▲ 。(填写编号)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
反应达若平衡后测得平衡常数为K,此时O2的转化率为x,则K和x的关系满足K= ▲ 。
(5)图1、2表示该SO2和O2的反应在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况:
① 图1中时刻t2发生改变的条件是 ▲ 。
② 图2中时刻t2发生改变的条件是 ▲ 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下, 将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中, 在催化剂存在下进行下列反应: 2SO2(g) + O2(g)  2SO3(g); △H= -197 kJ/ mol, 当达到平衡状态时, 下列说法中正确的是
2SO3(g); △H= -197 kJ/ mol, 当达到平衡状态时, 下列说法中正确的是
A.生成 SO3 为2 mol B.反应放出 197 kJ 的热量
C.SO2 和 SO3 物质的量之和一定为 2mol
D.SO2 的物质的量和SO3 物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表示正确的是 ( )。
A.往FeI2溶液中通入过量氯气:C l2+2Fe2+===2Cl-+2Fe3+
l2+2Fe2+===2Cl-+2Fe3+
B.将明矾溶于水中生成胶体:Al3++3H 2OAl(OH)3(胶体)+3H+
2OAl(OH)3(胶体)+3H+
C.大理石溶于醋酸中:CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+
CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com