
【题目】下列说法正确的是
A. 单位体积溶液里所含的溶质的物质的量,叫做物质的量浓度
B. 气体摩尔体积就是22.4 L /mol
C. 摩尔质量就是微粒的相对分子质量或者相对原子质量
D. 物质的量就是物质的质量
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1molL﹣1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01molL﹣1的下列五种物质的溶液中,酸性最强的是;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其KSp=2.8×10﹣9 . 现将浓度为2×10﹣4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、E为金属单质,B是淡黄色粉末且常用于防毒面具中,回答下题。
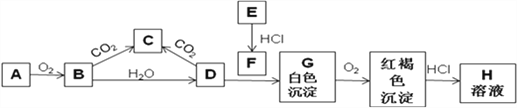
(1)实验室中A常常保存在盛放__________的广口瓶中。
(2)写出B转变成C的化学方程式_______________________。0.1molB参与该反应,转移电子的个数为_________ 。
(3)用化学方程式表示沉淀G颜色发生变化的原因:____________________________________________。
(4)从A、B、C、D、E、G、H选出试剂可制备F,写出对应离子方程式:______________________________________;
(5)直接向F溶液中加入B固体,写出可能出现的现象:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
弱酸 | CH3COOH | H2CO3 | HNO2 |
电离常数(25℃) | K=1.8×10﹣5 | K=4.3×10﹣7 | K=5.0×10﹣4 |
请回答下列问题:
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH﹣)c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3 , 所得混合液的pH=6,则混合液中 ![]() = .
= .
(3)常温下,将20mL 0.1molL﹣1 CH3COOH溶液和20mL0.1molL﹣1HNO2溶液分别与20mL 0.1 molL﹣1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是(填写序号);反应结束后所得两溶液中,c(CH3COO﹣) c(NO2﹣)(填“>”、“<”或“=”);
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3H2O的电离常数Kb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题: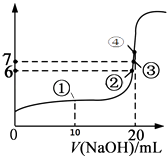
(1)若0.1mol/L的氢氟酸溶液中有0.1%的HF发生电离,则溶液的pH=;
(2)滴加NaOH溶液至恰好反应的过程中,水的电离程度(填写“逐渐增大”、“不变”、“逐渐减小”);
(3)①点时,NaOH加入了10mL,此时溶液中各种微粒(不包括水)的浓度由大到小的顺序是;
(4)③点时pH=7,此时溶液中c(F﹣)c(Na+)(填写>、<或=);
(5)④点时,NaOH加入了20mL,此时溶液中有两种微粒浓度之和等于0.05mol/L,这两种微粒是和;
(6)若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HF溶液的浓度,推测最好使用的指示剂为(常见指示剂的变色范围是:甲基橙3.1~4.4,酚酞8~10).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体和蒸馏水准确配制一定物质的量浓度的NaOH溶液.以下仪器中,不需要用到的是( )
A.烧杯
B.玻璃棒
C.容量瓶
D.蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
B.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2NA
C.NO2和H2O反应每生成2molHNO3时转移的电子数目为2NA
D.lmolFe在氧气中充分燃烧失去3NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com