
在一定条件下可实现下列物质间的转化,如下图所示: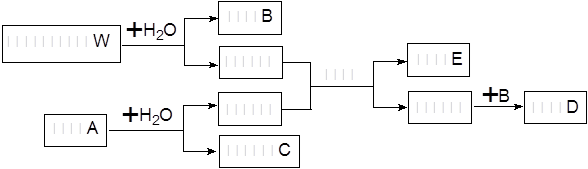
(1)固体A是一种重要的工业原料,其化学式为____________________。W的电子式为_____ ____
(2)写出W与气体丙反应的化学方程式___________________________
(3)利用上图中有关物质实现C→B的转变,写出该转变的离子方程式:__________ _____
(4)上述变化中的B和丙按物质的量3:2反应的离子方程式为:_______。
(5)若甲和乙恰好完全反应,则W与A的物质的量之比为_______。
(1)CaC2 , 
(2)2Na2O2+2CO2=2Na2CO3+O2
(3)Ca(OH)2+CO32-=CaCO3+2OH-
(4)3OH-+2CO2=HCO3-+CO32-+H2O
(5)5:1
解析试题分析:浅黄色固体和水反应放出气体,可以推断出W是Na2O2,B是NaOH,甲是氧气,气体丙也能和Na2O2反应,说明丙是CO2,E是水,则气体乙应该是烃或烃的含氧衍生物,能和水反应生成乙可以推断出实验室制备乙炔,A是CaC2,C是氢氧化钙。(4)根据电荷守恒和原子个数守恒可以写出3OH-+2CO2=HCO3-+CO32-+H2O,(5)2Na2O2产生1摩尔氧气,1摩尔乙炔燃烧需要2.5molO2,需要CaC2原料1摩尔,由此可以计算出结果5:1
考点:考查元素化合物的性质、离子方程式的书写、物质的量的计算


科目:高中化学 来源: 题型:填空题
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: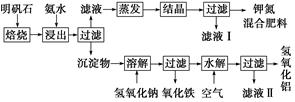
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是_________________________________________________________________。
(3)写出沉淀物中所有物质的化学式___________________________________。
(4)滤液Ⅰ的成分是水和______________________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为__________mol(用含有m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O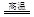 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是 ,若反应中转移1mol电子,得到Cu mol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法 (填“正确”或“不正确”),原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: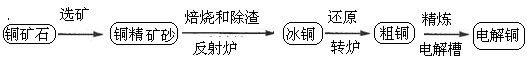
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。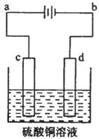
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题: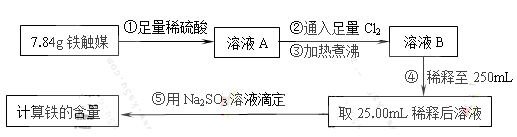
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸 mL
(2)步骤②通入Cl2的目的是 (用离子方程式表示)
(3)步骤④后需用 (填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为 。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式 ,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的 作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下: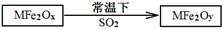
则可以判断x y,氧化性:MFe2Oy SO2(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速。完成下列填空:
(1)在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是: ;
(2)硅与铝同周期。地壳里硅、铝的含量硅 铝(填>,<或=)。SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。钠长石(NaAlSi3O8)的氧化物形式 ,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由此可推知钙长石的化学式为 ;
(3)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu + H2SO4
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是 (填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是 。发生反应的离子方程式为 ;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为 。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(6分) 向1L AlCl3和FeCl3混合溶液中加入2mol /LNaOH溶液300mL时,产生的沉淀量达最大值;继续加入NaOH溶液,沉淀开始溶解,当加入NaOH溶液的总体积达到 350mL时,沉淀不再减少,求原溶液中FeCl3的物质的量浓度(需写出解题过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com