
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: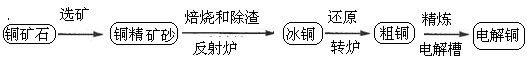
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。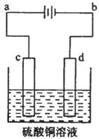
(1) 2CuFeS2 + O2 Cu2S + 2FeS + SO2
Cu2S + 2FeS + SO2
2FeS + 3O2 2FeO + 2SO2, FeSiO3;(该空1分,其余每空2分)
2FeO + 2SO2, FeSiO3;(该空1分,其余每空2分)
(2) 2Cu2S + 3O2 2Cu2O + 2SO2、 Cu2S + 2Cu2O
2Cu2O + 2SO2、 Cu2S + 2Cu2O  6Cu + SO2↑
6Cu + SO2↑
(3) c; Cu2+ + 2e- = Cu; Au、Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解质溶液中。
解析试题分析:(1) Cu和Fe的低价硫化物为Cu2S 和 2FeS,因此有: 2CuFeS2 + O2 Cu2S + 2FeS + SO2
Cu2S + 2FeS + SO2
2FeS + 3O2 2FeO + 2SO2,反射炉内生成炉渣的主要成分是 FeSiO3,因为是炼铜的一个反应,所以为应该含有铜的硅酸盐。
2FeO + 2SO2,反射炉内生成炉渣的主要成分是 FeSiO3,因为是炼铜的一个反应,所以为应该含有铜的硅酸盐。
(2) 依题中提供的信息有:2Cu2S + 3O2 2Cu2O + 2SO2、 Cu2S + 2Cu2O
2Cu2O + 2SO2、 Cu2S + 2Cu2O  6Cu + SO2↑
6Cu + SO2↑
(3) 电解精炼铜时,阳极挂的是粗铜,阴极挂的是纯铜,电解质溶液是含有铜的盐,连接电池负极的是电解池的阴极,连接电池正极的是电解池的阳极。所以粗铜板是图中电极c;在电极d上发生的电极反应式为Cu2+ + 2e- = Cu; Au、Ag以单质的形式沉积在c(阳极)下方,形成所谓的“阳极泥”,Fe以Fe2+的形式进入电解质溶液中。
考点:炼铜的有关知识。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:填空题
铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是 。
(2)由于氧化性Fe3+>Cu2+氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是 。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是 (用离子方程式表示)。在使用时发现硫酸铁不能将酸性废水中的悬浮物沉降除去,其原因是 。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4十4CO 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 一定温度下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下: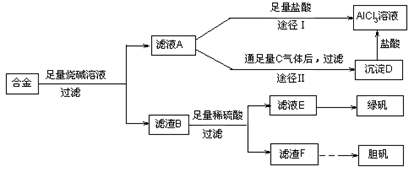
请回答下列问题:
(1)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 ,理由是:
。
(2)从滤液E中得到绿矾晶体的实验操作是 。
(3)请用一个总反应式表示由滤渣F制备胆矾晶体过程中发生的变化:
。
(4)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将一定质量的Mg和Al的混合物投入2.0 mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。回答下列问题: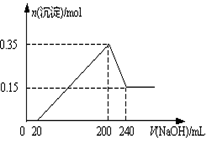
(1)由图可知加入镁的物质的量是 _____________________。
(2)当加入NaOH溶液的体积小于20mL时发生的离子反应是__________,当加入NaOH溶液的体积大于200 mL时发生的离子反应是______________。
(3)NaOH溶液的物质的量浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸亚铁铵【(NH4)2Fe(SO4)2】俗称莫尔盐,工业上用途广泛,该物质属于 。
A、酸 B、碱 C、盐
某同学为了验证硫酸亚铁铵晶体中的阳离子,进行了如下操作。
(1)室温下,将少量的硫酸亚铁铵晶体配成溶液,并将所配溶液分置于两支试管中,用其中一支进行验证Fe2+的实验,请完成下表:
| 操作 | ①往试管中滴入几滴 溶液(填化学式) | ②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(一).对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法: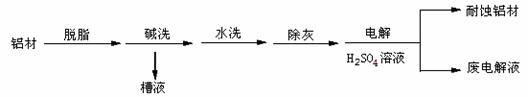
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出, 为将槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。 (填编号)
a.NH3 b.CO2 c.NaOH d.HNO3
(2)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,
阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液,写出发生反应的离子方程式
(二).A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定条件下可实现下列物质间的转化,如下图所示: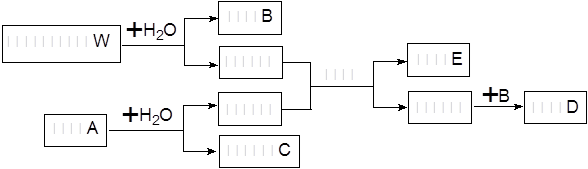
(1)固体A是一种重要的工业原料,其化学式为____________________。W的电子式为_____ ____
(2)写出W与气体丙反应的化学方程式___________________________
(3)利用上图中有关物质实现C→B的转变,写出该转变的离子方程式:__________ _____
(4)上述变化中的B和丙按物质的量3:2反应的离子方程式为:_______。
(5)若甲和乙恰好完全反应,则W与A的物质的量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组模拟工业上从铝土矿(主要成分是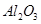 ,含
,含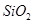 、
、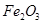 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: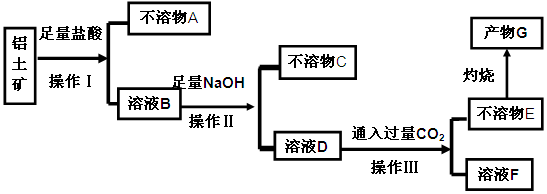
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(2)验证溶液B中是否含有Fe3+的方法: 。
(3)不溶物A是 (填化学式),写出D→E反应的离子方程式 。
(4)说出溶液F中含碳元素溶质的一种用途 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。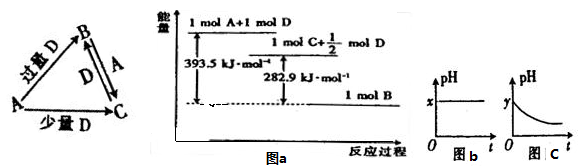
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 ;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 ;
②反应B+A→C的离子方程式为 ;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为 ;
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com