
 CH3OH(g)
CH3OH(g) | A.生成CH3OH的速率与消耗CO的速率相等 |
| B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 |
| D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5 mol·L-1 | 2mol·L-1 | 6mol·L-1 |


 CH3OH(g),其体积减小,则相当于压强增大,化学平衡向正反应方向移动,乙容器中CO的转化率增大,但压强大,反应速率快,则达到平衡的时间变短,CO的转化率随时间变化的图象为
CH3OH(g),其体积减小,则相当于压强增大,化学平衡向正反应方向移动,乙容器中CO的转化率增大,但压强大,反应速率快,则达到平衡的时间变短,CO的转化率随时间变化的图象为 。
。

科目:高中化学 来源:不详 题型:单选题
 2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )| A.②④ | B.①④ | C.①③④ | D.②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g) △H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
2Z(g) △H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
| A.△H>0,X为气体 | B.△H>0,X为固体 |
| C.△H<0,X为气体 | D.△H<0,X为固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
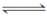 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。| A.以O2浓度变化表示的反应速率为0.064 mol·(L·s)-1 |
| B.反应达到平衡状态时NH3的转化率为20% |
C.升高温度能使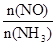 减小 减小 |
| D.将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) (催化剂为Cu2O/ZnO),根据题意完成下列各题:
CH3OH(g) (催化剂为Cu2O/ZnO),根据题意完成下列各题: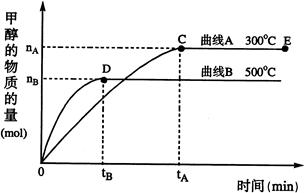
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 I3-(aq), 某I2、KI混合溶液中, c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。
I3-(aq), 某I2、KI混合溶液中, c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。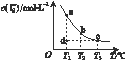
A.反应 I2(aq)+I-(aq) I3-(aq)ΔH>0 I3-(aq)ΔH>0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1 |
| C.若T1时,反应进行到状态d时,一定有υ正 >υ逆 |
| D.状态a与状态b相比,状态b时I2的转化率更高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 cZ(g);△H=Q,有下图所示关系,下列判断中正确是( )
cZ(g);△H=Q,有下图所示关系,下列判断中正确是( )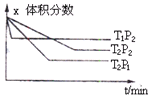
| A.a+b < c, Q > 0 | B.a+b < c, Q < 0 |
| C.a+b > c, Q > 0 | D.a+b > c, Q < 0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
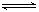 eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是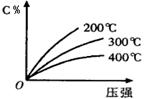
| A.达到平衡后,加入催化剂,C%不变 |
| B.该反应为放热反应 |
| C.化学方程式中m+n>e+f |
| D.达到平衡后,增加A的质量有利于平衡向右移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com