
【题目】阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,正确的是

A. 阿克拉酮的分子式为C22H23O8
B. 分子中含有5个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质与 NaOH溶液反应,最多可反应3 mol NaOH
科目:高中化学 来源: 题型:
【题目】碳酸钙可用作食品添加剂。以磷石膏(主要成分为CaSO4·2H2O)为原料制备碳酸钙的一种工艺流程如下:

(1)已知磷石膏“水洗”前后的部分杂质质量分数变化如下表:
SiO2 | P2O5 | Al2O3 | F- | Fe2O3 | |
水洗前/% | 9.21 | 3.08 | 0.55 | 0.68 | 0.19 |
水洗后/% | 8.96 | 1.37 | 0.46 | 0.29 | 0.27 |
则“水洗“除去的主要杂质是___________。
(2)气体A的化学式为_______。
(3)“碳化”时发生反应的化学方程式为____________。其他条件一定时,“碳化”反应中CaSO4的转化率随温度的变化如右图所示,温度高于45℃,CaSO4的转化率下降的原因是________。

(4)工业上电解(NH4)2SO4溶液可制取过二硫酸铵[(NH4)2S2O8],其中S2O82-的结构如下。电解时阳极的电极反应式为__________,过二硫酸铵可用于游泳池中水的消毒,其原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)电化学降解NO3-的原理如图1所示,电源正极为_____ (填“a”或“b”); 阴极电极反应式为____.

Ⅱ.工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇。已知298K 和101KPa 条件下:
2H2(g)+O2(g)= 2H2O(1) ΔH1= -571.6kJ/mol
CO(g)+1/2O2(g)= CO2(g) ΔH2= -283.0kJ/mol
CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol
(2)则CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=____kJ/mol
CH3OH(1) ΔH=____kJ/mol
(3)已知:CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;
CO(g)+2H2(g) ![]() CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。
CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。

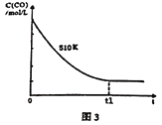
(4)维持反应温度为510K,以n(H2)/n(CO)=2:1充入一定量的原料气于1 L容器中,在上述条件下充分反应,t1时刻达到平衡测得容器中c(CH3OH)=2mol/L.则平衡时CO 转化率=______;若维持反应温度为520K,其它条件不变,请在图3中画出c(CO)在0~t1时刻变化曲线。__________________
(5)20世纪90年代,化学家研制出新型催化剂: 碱金属的醇盐及溶剂用于合成甲醇。图4是在该新型催化剂作用下,研究温度、压强对合成甲醇的影响。由图可知适宜的反应温度、压强分别为_____ (填字母)。
温度A.90-150℃ B.200-260℃ C.300-360℃ D.400-460℃
压强E.0.1~1MPa F.3~5 MPa G.8~10MPa H.15~20MPa

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。

(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土(主要成分为SiO2,含有少量的Fe2O3、 Al2O3) 为载体的V2O5-K2SO4常用作接触法制硫酸的催化剂。以下是一种废钒催化剂综合回收利用的工艺路线。

已知: 废钒催化剂中钒元素主要以VOSO4和V2O5形式存在;
V2O5是两性氧化物,不溶于水,溶于酸生成VO2+,溶于碱生成VO3-;
VOSO4是强电解质,溶于水电离出VO2+。
回答下列问题:
(1)VOSO4中V 元素的化合价为___________。
(2)滤渣①酸溶后加入的最佳试剂X 为_________。
a.NaClO b.Na2SO3c.K2SO3d.K2S
(3)从滤液③中得到产品K2SO4的操作为_________。滤渣③除含有V2O2(OH)4,还含有_________。
(4)若滤液⑤中c(VO3-)=0.1mol·L-1,为使钒元素的沉淀率达到98%,至少应调节c(NH4+)为_________[Ksp(NH4VO3)=1.6×10-3]。
(5)“焙烧”时通入足量的空气,反应后的尾气可以直接排放。该反应的化学方程式为____________。
(6) V2O5纯度测定原理: 称取V2O5产品ag,先加入硫酸将V2O5转化为VO2+,再加入V1 mLc1mol·L-1(NH4) 2Fe(SO4) 2溶液将VO2+转 化为VO2+,最 后 用c2mol·L-1KMnO4 溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液V2mL。假设杂质不参与反应,实验测得某V2O5产品的纯度为91%,则理论上加入(NH4)2Fe(SO4)2溶液的体积V1至少_________mL (用相关字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液的氧化性,催熟水果
D.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. M点时,Y的转化率最大
B. 升高温度,平衡常数减小
C. 平衡后充入Z,达到新平衡时Z的体积分数增大
D. W、M两点Y的正反应速率相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com