
【题目】I.(1)电化学降解NO3-的原理如图1所示,电源正极为_____ (填“a”或“b”); 阴极电极反应式为____.

Ⅱ.工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇。已知298K 和101KPa 条件下:
2H2(g)+O2(g)= 2H2O(1) ΔH1= -571.6kJ/mol
CO(g)+1/2O2(g)= CO2(g) ΔH2= -283.0kJ/mol
CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol
(2)则CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=____kJ/mol
CH3OH(1) ΔH=____kJ/mol
(3)已知:CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;
CO(g)+2H2(g) ![]() CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。
CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。

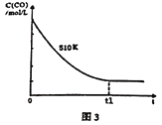
(4)维持反应温度为510K,以n(H2)/n(CO)=2:1充入一定量的原料气于1 L容器中,在上述条件下充分反应,t1时刻达到平衡测得容器中c(CH3OH)=2mol/L.则平衡时CO 转化率=______;若维持反应温度为520K,其它条件不变,请在图3中画出c(CO)在0~t1时刻变化曲线。__________________
(5)20世纪90年代,化学家研制出新型催化剂: 碱金属的醇盐及溶剂用于合成甲醇。图4是在该新型催化剂作用下,研究温度、压强对合成甲醇的影响。由图可知适宜的反应温度、压强分别为_____ (填字母)。
温度A.90-150℃ B.200-260℃ C.300-360℃ D.400-460℃
压强E.0.1~1MPa F.3~5 MPa G.8~10MPa H.15~20MPa

【答案】 a 2NO3-+12H++10e-=N2+6H2O ΔH=-128.1kJ/mol I 97.56% (或97.6%或98%)  A、F
A、F
【解析】I.(1)硝酸根离子得电子生成氮气,则b相连的电极为阴极,所以b为负极,a为正极,阴极上的反应为:2NO3-+10e-+12H+=6H2O+N2↑;故答案为:a;2NO3-+10e-+12H+=6H2O+N2↑;
Ⅱ. (2) ①2H2(g)+O2(g)= 2H2O(1) ΔH1= -571.6kJ/mol,②CO(g)+ ![]() O2(g)= CO2(g) ΔH2= -283.0kJ/mol,③CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol,根据盖斯定律,将①+②-③得:CO(g)+2H2 (g)
O2(g)= CO2(g) ΔH2= -283.0kJ/mol,③CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol,根据盖斯定律,将①+②-③得:CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=(-571.6kJ/mol)+(-283.0kJ/mol)- (-726.5kJ/mol)=-128.1kJ/mol,故答案为:-128.1;
CH3OH(1) ΔH=(-571.6kJ/mol)+(-283.0kJ/mol)- (-726.5kJ/mol)=-128.1kJ/mol,故答案为:-128.1;
(3) ①CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=-128.1kJ/mol,②CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;根据盖斯定律,①+②得,CO(g)+2H2(g)
CH3OH(1) ΔH=-128.1kJ/mol,②CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;根据盖斯定律,①+②得,CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-92.9 kJ/mol,升高温度,平衡逆向移动,平衡常数K减小,因此平衡常数K 随温度变化关系的曲线为图2 中的I,故答案为:I;
CH3OH(g) ΔH=-92.9 kJ/mol,升高温度,平衡逆向移动,平衡常数K减小,因此平衡常数K 随温度变化关系的曲线为图2 中的I,故答案为:I;
(4)设开始时充入的氢气和一氧化碳的物质的量分别为2x,x,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
开始(mol/L) x 2x 0
反应(mol/L) 2 4 2
平衡(mol/L) x-2 2x-4 2
510K时K=4×103,则![]() =4×103,解得x=2.05mol,CO 转化率=
=4×103,解得x=2.05mol,CO 转化率=![]() ×100%=97.56%;若维持反应温度为520K,温度升高,平衡逆向移动,平衡是CO的浓度增大,建立平衡需要的时间减少,图像为
×100%=97.56%;若维持反应温度为520K,温度升高,平衡逆向移动,平衡是CO的浓度增大,建立平衡需要的时间减少,图像为 ,故答案为:97.56%;
,故答案为:97.56%; ;
;
(5)根据反应方程式CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-92.9 kJ/mol,温度越高,CO的转化率越低,压强越大,CO的转化率越大;根据图像,温度在90-150℃左右,压强在3~5 MPa时,CO的转化率已经较高,再增大压强,对设备的要求增大,成本升高,故选AF。
CH3OH(g) ΔH=-92.9 kJ/mol,温度越高,CO的转化率越低,压强越大,CO的转化率越大;根据图像,温度在90-150℃左右,压强在3~5 MPa时,CO的转化率已经较高,再增大压强,对设备的要求增大,成本升高,故选AF。


科目:高中化学 来源: 题型:
【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为制备消毒液(主要成分是NaClO),设计了下列装置,并查阅到下边资料:在加热情况下氯气和碱溶液能发生反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。
5Cl-+ClO3-+3H2O。

请回答下列问题:
(1)连接好装置,装药品之前,必须进行的一项操作步骤是________________。
(2)圆底烧瓶内发生反应的化学方程式为____________________________;大试管内发生反应的离子方程式为_______________________________________。
(3)饱和食盐水的作用是_____________;冰水的作用是___________________。
(4)在制取C12时,实验室中若无MnO2,可用KMnO4粉末代替,发生下列反应:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,则可选择的发生装置是_____(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下取金属钠、铝、铁各1克,加入1mol/L的硫酸V升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是( )
A. V≥![]() B. V≤
B. V≤![]() C. V<
C. V<![]() D. V≤
D. V≤![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁黄是一种重要的颜料,化学式为Fe2O3xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:

(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是________、________。
(2)试剂a最好选用______(供选择使用的有:铝粉、空气、浓HNO3);其作用是________。
(3)上述步骤中需用到氨气.下列装置可用于实验室制氨气的是______(填序号)。

(4)检验溶液Z中含有NH4+的方法是________。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。

根据图像推断650℃时Fe2O3还原产物的化学式为________,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)________。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl﹣浓度最小的是( )
A.200mL 2mol/L MgCl2溶液B.1000mL 2.5mol/L NaCl溶液
C.300mL 5mol/L KCl溶液D.250mL 1mol/L AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,正确的是

A. 阿克拉酮的分子式为C22H23O8
B. 分子中含有5个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质与 NaOH溶液反应,最多可反应3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类全部正确的是( )
①纯碱 ②食盐水 ③石灰水 ④NaHSO4 ⑤液态氧 ⑥NaOH.
A.盐﹣﹣①④
B.碱﹣﹣①⑥
C.纯净物﹣﹣③④⑤
D.混合物﹣﹣②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com