
【题目】下列各组混合物可用分液漏斗分离的一组是( )
A.汽油和水
B.碘和四氯化碳
C.淀粉溶液和泥沙
D.水和酒精
科目:高中化学 来源: 题型:
【题目】Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)电池的负极材料为 ,发生的电极反应为 ;
(1)电池的负极材料为 ,发生的电极反应为 ;
![]() (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
![]() (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
![]() (4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(1) 复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。
A.BaFe2O4 B.NaHSO4 C.KAl(SO4)2·12H2O D.Ag (NH3)2OH
(2) 硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:

①“氧化”得到CeO2的化学方程式为________________________________。
②证明CeO2已经洗涤干净的方法是_____________________________。
(3) 为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成100.00 mL溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O4 0.2290 g。通过计算确定该样品的化学式(写出计算过程) __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应速率的大小主要取决于浓度、温度、压强等外界因素
B. 化石燃料是不可再生能源,生物质能是可再生能源
C. 许多水果与花卉的芳香气味其实是水果花卉中含有的酯的气味
D. 人工合成尿素,彻底动摇了“生命力论”,使得有机化学迅猛发展
【答案】A
【解析】试题分析:A.化学反应速率的大小主要由反应物本身的性质决定。错误;B.化石燃料是不可再生能源,生物质能是绿色植物通过光合作用产生的,是可再生能源,正确;C.酯是一类有芳香气味的物质,许多水果与花卉的芳香气味是因含有酯的原因,正确;D.人工合成尿素,完成了无机物和有机物的转化,彻底动摇了“生命力论”,使有机化学迅猛发展,正确;故选A。
考点:考查了化学反应速率的决定因素、物质的分类、化学史、酯的性质的相关知识。
【题型】单选题
【结束】
16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列有关实验的说法不合理的是( )

A. 反应一段时间,①中试管底部有少量固体生成
B. ②中用品红溶液验证SO2的生成
C. ③中用石蕊溶液检验SO2溶液的酸碱性
D. 向①中直接加水,观察颜色,确认CuSO4生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)电化学降解NO3-的原理如图1所示,电源正极为_____ (填“a”或“b”); 阴极电极反应式为____.

Ⅱ.工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇。已知298K 和101KPa 条件下:
2H2(g)+O2(g)= 2H2O(1) ΔH1= -571.6kJ/mol
CO(g)+1/2O2(g)= CO2(g) ΔH2= -283.0kJ/mol
CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol
(2)则CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=____kJ/mol
CH3OH(1) ΔH=____kJ/mol
(3)已知:CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;
CO(g)+2H2(g) ![]() CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。
CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。

(4)维持反应温度为510K,以n(H2)/n(CO)=2:1充入一定量的原料气于1 L容器中,在上述条件下充分反应,t1时刻达到平衡测得容器中c(CH3OH)=2mol/L.则平衡时CO 转化率=______;若维持反应温度为520K,其它条件不变,请在图3中画出c(CO)在0~t1时刻变化曲线。__________________
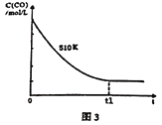
(5)20世纪90年代,化学家研制出新型催化剂: 碱金属的醇盐及溶剂用于合成甲醇。图4是在该新型催化剂作用下,研究温度、压强对合成甲醇的影响。由图可知适宜的反应温度、压强分别为_____ (填字母)。
温度A.90-150℃ B.200-260℃ C.300-360℃ D.400-460℃
压强E.0.1~1MPa F.3~5 MPa G.8~10MPa H.15~20MPa

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物与人类生产、 生活密切相关。请回答下列问题:
(1)羰基硫(O=C=S) 能引起催化剂中毒和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应原理为:
①氢解反应: COS(g)+H2(B)![]() H2S(g)+CO(g) △H1
H2S(g)+CO(g) △H1
②水解反应: COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35 kJ·mol-1
H2S(g)+CO2(g) △H2=-35 kJ·mol-1
已知CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=______,羰基硫氢解反应_________(填“能”或“示能”) 设计成原电池。若平衡常数K 与温度T之间存在1gK=a/T+b (a、b为常数) 的线性关系,图中直线符合该氢解反应平衡常数K与温度T关系的是_________ (填字母)。
H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=______,羰基硫氢解反应_________(填“能”或“示能”) 设计成原电池。若平衡常数K 与温度T之间存在1gK=a/T+b (a、b为常数) 的线性关系,图中直线符合该氢解反应平衡常数K与温度T关系的是_________ (填字母)。

(2)CO 可以合成甲醇 CO(g)+2H2(g)![]() CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为_________;反应速率N 点v 正(CO)_________M 点v逆(CO) (填“>”“<”或“=”)。
CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为_________;反应速率N 点v 正(CO)_________M 点v逆(CO) (填“>”“<”或“=”)。

(3)焦炭还原NO2 发生反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=_________(Kp是用平衡分压代替平衡浓度表达反应的平衡常数,分压=总压×物质的量分数)。
N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=_________(Kp是用平衡分压代替平衡浓度表达反应的平衡常数,分压=总压×物质的量分数)。

(4)常温下,用氨水吸收CO2得到NH4HCO3溶液。在NH4HCO3 溶液中c(NH4+)________c(HCO3-)(填“>”“<”或“=”)
。反应NH4++HCO3-+ H2O![]() NH3· H2O +H2CO3 的平衡常数K=_________。(已知常温下H2CO3的Ka1=4×10-7mol·L-1,Ka2=4×10-11 mol·L-1,NH3·H2O 的Kb=2×10-5mol·L-1)
NH3· H2O +H2CO3 的平衡常数K=_________。(已知常温下H2CO3的Ka1=4×10-7mol·L-1,Ka2=4×10-11 mol·L-1,NH3·H2O 的Kb=2×10-5mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土(主要成分为SiO2,含有少量的Fe2O3、 Al2O3) 为载体的V2O5-K2SO4常用作接触法制硫酸的催化剂。以下是一种废钒催化剂综合回收利用的工艺路线。

已知: 废钒催化剂中钒元素主要以VOSO4和V2O5形式存在;
V2O5是两性氧化物,不溶于水,溶于酸生成VO2+,溶于碱生成VO3-;
VOSO4是强电解质,溶于水电离出VO2+。
回答下列问题:
(1)VOSO4中V 元素的化合价为___________。
(2)滤渣①酸溶后加入的最佳试剂X 为_________。
a.NaClO b.Na2SO3c.K2SO3d.K2S
(3)从滤液③中得到产品K2SO4的操作为_________。滤渣③除含有V2O2(OH)4,还含有_________。
(4)若滤液⑤中c(VO3-)=0.1mol·L-1,为使钒元素的沉淀率达到98%,至少应调节c(NH4+)为_________[Ksp(NH4VO3)=1.6×10-3]。
(5)“焙烧”时通入足量的空气,反应后的尾气可以直接排放。该反应的化学方程式为____________。
(6) V2O5纯度测定原理: 称取V2O5产品ag,先加入硫酸将V2O5转化为VO2+,再加入V1 mLc1mol·L-1(NH4) 2Fe(SO4) 2溶液将VO2+转 化为VO2+,最 后 用c2mol·L-1KMnO4 溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液V2mL。假设杂质不参与反应,实验测得某V2O5产品的纯度为91%,则理论上加入(NH4)2Fe(SO4)2溶液的体积V1至少_________mL (用相关字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A.Al2(SO4)3=2Al3+ + 3SO42-B.NaHCO3=Na+ + HCO3-
C.Ba(OH)2= Ba2+ + 2 OH-D.H2SO4=H2++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com