
【题目】常温下取金属钠、铝、铁各1克,加入1mol/L的硫酸V升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是( )
A. V≥![]() B. V≤
B. V≤![]() C. V<
C. V<![]() D. V≤
D. V≤![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E是原子序数依次增大前20号元素。A原子价电子层p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素。回答下列问题:
(1)B3+的结构示意图为______,C的最高价氧化物对应水化物与E的最高价氧化物对应水化物按物质的量1:1反应的离子方程式为__________。
(2)上述五种元素中碱性最强物质的电子式为_________; D所在周期第一电离能最大的元素是________;AD3是_________分子(填“极性”或“非极性”)
(3)B单质为面心立方晶体,晶胞中B原子的配位数为_________.
(4)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钙可用作食品添加剂。以磷石膏(主要成分为CaSO4·2H2O)为原料制备碳酸钙的一种工艺流程如下:

(1)已知磷石膏“水洗”前后的部分杂质质量分数变化如下表:
SiO2 | P2O5 | Al2O3 | F- | Fe2O3 | |
水洗前/% | 9.21 | 3.08 | 0.55 | 0.68 | 0.19 |
水洗后/% | 8.96 | 1.37 | 0.46 | 0.29 | 0.27 |
则“水洗“除去的主要杂质是___________。
(2)气体A的化学式为_______。
(3)“碳化”时发生反应的化学方程式为____________。其他条件一定时,“碳化”反应中CaSO4的转化率随温度的变化如右图所示,温度高于45℃,CaSO4的转化率下降的原因是________。

(4)工业上电解(NH4)2SO4溶液可制取过二硫酸铵[(NH4)2S2O8],其中S2O82-的结构如下。电解时阳极的电极反应式为__________,过二硫酸铵可用于游泳池中水的消毒,其原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述不正确的是( )
A. 可用稀硝酸清洗做过银镜反应实验的试管
B. 用NaOH溶液可鉴别分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阴离子的溶液
C. 向沸腾的NaOH稀溶液中逐滴滴加FeCl3饱和溶液,可制备Fe(OH)3胶体
D. 配制浓硫酸和浓硝酸的混合酸时,应将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应速率的大小主要取决于浓度、温度、压强等外界因素
B. 化石燃料是不可再生能源,生物质能是可再生能源
C. 许多水果与花卉的芳香气味其实是水果花卉中含有的酯的气味
D. 人工合成尿素,彻底动摇了“生命力论”,使得有机化学迅猛发展
【答案】A
【解析】试题分析:A.化学反应速率的大小主要由反应物本身的性质决定。错误;B.化石燃料是不可再生能源,生物质能是绿色植物通过光合作用产生的,是可再生能源,正确;C.酯是一类有芳香气味的物质,许多水果与花卉的芳香气味是因含有酯的原因,正确;D.人工合成尿素,完成了无机物和有机物的转化,彻底动摇了“生命力论”,使有机化学迅猛发展,正确;故选A。
考点:考查了化学反应速率的决定因素、物质的分类、化学史、酯的性质的相关知识。
【题型】单选题
【结束】
16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试判断下列物质能否溶于水,能溶于水的组合是( )
①葡萄糖 ②己六醇 ③硬脂酸 ④硬脂酸钠 ⑤硬脂酸镁 ⑥乙二酸 

A. ①②④⑥⑦⑨ B. 全溶 C. 除⑤⑧外全溶 D. ①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)电化学降解NO3-的原理如图1所示,电源正极为_____ (填“a”或“b”); 阴极电极反应式为____.

Ⅱ.工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇。已知298K 和101KPa 条件下:
2H2(g)+O2(g)= 2H2O(1) ΔH1= -571.6kJ/mol
CO(g)+1/2O2(g)= CO2(g) ΔH2= -283.0kJ/mol
CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol
(2)则CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=____kJ/mol
CH3OH(1) ΔH=____kJ/mol
(3)已知:CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;
CO(g)+2H2(g) ![]() CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。
CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。

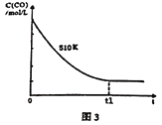
(4)维持反应温度为510K,以n(H2)/n(CO)=2:1充入一定量的原料气于1 L容器中,在上述条件下充分反应,t1时刻达到平衡测得容器中c(CH3OH)=2mol/L.则平衡时CO 转化率=______;若维持反应温度为520K,其它条件不变,请在图3中画出c(CO)在0~t1时刻变化曲线。__________________
(5)20世纪90年代,化学家研制出新型催化剂: 碱金属的醇盐及溶剂用于合成甲醇。图4是在该新型催化剂作用下,研究温度、压强对合成甲醇的影响。由图可知适宜的反应温度、压强分别为_____ (填字母)。
温度A.90-150℃ B.200-260℃ C.300-360℃ D.400-460℃
压强E.0.1~1MPa F.3~5 MPa G.8~10MPa H.15~20MPa

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。

(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com