
【题目】试判断下列物质能否溶于水,能溶于水的组合是( )
①葡萄糖 ②己六醇 ③硬脂酸 ④硬脂酸钠 ⑤硬脂酸镁 ⑥乙二酸 

A. ①②④⑥⑦⑨ B. 全溶 C. 除⑤⑧外全溶 D. ①④⑥⑦
【答案】A
【解析】—OH、—COOH、—CHO都是亲水基,但比—COO- 、—SO3-亲水性差,-R、-NO2、—X和酯基为憎水基.当有机物分子中亲水基占主导地位时,该有机物溶于水,当有机物分子中憎水基占主导地位时,该有机物难溶于水。①②⑥中相当于每个C原子上都有亲水基,所以易溶于水;③中的亲水基—COOH与憎水基—C17H35相比不占主导地位,所以不易溶于水;④中—COOH变为亲水性更强的—COO-,导致亲水基占主导地位,所以可溶于水;⑤中硬脂酸镁为(C17H35COO)2Mg,憎水基增大,溶解性减弱,所以硬脂酸镁不易溶于水;⑦中憎水基较小,所以可溶于水;⑧中苯酚溶解度不大,加上3个憎水的溴原子后,更不易溶解于水中;⑨和⑩区别在于烷基大小不同,导致憎水基的地位发生变化,⑩由于憎水基太大,难溶于水,而⑨易溶于水,根据上述分析可知,答案选A。


科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)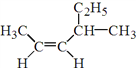 的名称是______________________________。
的名称是______________________________。
(2)![]() 中官能团的名称为______________,该物质与足量NaOH(aq)反应的化学方程式是___________________________,
中官能团的名称为______________,该物质与足量NaOH(aq)反应的化学方程式是___________________________,![]() 转化为
转化为![]() 所用试剂是________________(填化学式)。
所用试剂是________________(填化学式)。
(3)检验CH2=CHCHO中含有醛基的试剂是_______________(写一种即可),反应的化学方程式是__________________________________________。
(4)苯乙烯是一种重要的化工原料,合成苯乙烯的流程如下(A、B、C、D均为有机化合物):
 反应2的类型是____________________, 反应1的化学方程式是__________________,反应3的化学方程式是_______________________________________。
反应2的类型是____________________, 反应1的化学方程式是__________________,反应3的化学方程式是_______________________________________。
(5)写出由CH2=CH2合成CH3CH2CH2CH2OH的流程(无机试剂任选)_____。

(流程图示例:![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A |
| Fe2+、NO3-、Al3+、Cl- | 不能大量共存, 3Fe2++4H++NO3-=3Fe3++NO+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、AlO2- | 能大量共存 |
C | 含有大量Al3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存, 2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下取金属钠、铝、铁各1克,加入1mol/L的硫酸V升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是( )
A. V≥![]() B. V≤
B. V≤![]() C. V<
C. V<![]() D. V≤
D. V≤![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2), v逆= v(NO)消耗= 2v (O2 )消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2), v逆= v(NO)消耗= 2v (O2 )消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
下列说法正确的是
A. T1时,该反应的平衡常数为1
B. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
C. 达平衡时,容器Ⅲ中 NO 的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2> T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁黄是一种重要的颜料,化学式为Fe2O3xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:

(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是________、________。
(2)试剂a最好选用______(供选择使用的有:铝粉、空气、浓HNO3);其作用是________。
(3)上述步骤中需用到氨气.下列装置可用于实验室制氨气的是______(填序号)。

(4)检验溶液Z中含有NH4+的方法是________。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。

根据图像推断650℃时Fe2O3还原产物的化学式为________,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)________。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。

(1)在右图装置中,观察到装置甲铜电极上产生大量的无色气体; 而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论是__________________。
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____________________________________。

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr (Ⅲ) 常见的处理方法是电解法和铁氧磁体法。
①电解法: 将含Cr2O72- 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl 进行电解,使阳极生成的Fe2+和Cr2O72- 发生反应,其离子方程式为_______________。阴极上Cr2O72- 、H+、Fe3+都可能放电。若Cr2O72- 放电,则阴极的电极反应式为_________; 若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀,已知:Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-,则阴极区溶液pH 的范围为_________。
CrO2-,则阴极区溶液pH 的范围为_________。
②铁氧磁体法: 在含Cr (Ⅵ) 的废水中加入绿矾,在pH<4时发生反应使Cr (Ⅵ) 转化为Cr (Ⅲ),调节溶液pH 为6~8,使溶液中的Fe (Ⅱ)、F e(Ⅲ)、Cr (Ⅲ)析出组成相当于Fe(Ⅱ) [Fe(Ⅲ)x·Cr (Ⅲ)2-x] O4(铁氧磁体) 的沉淀,则铁氧磁体中x=_________; 若废水中Cr (Ⅵ) 以CrO3计,用该法除去废水中的Cr (Ⅵ),加入的FeSO4·7H2O 与CrO3的质量比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校高一研究性学习小组将造成该市空气污染的主要原因分为4种:
A.燃烧农作物秸秆
B.燃烧含硫煤
C.粉尘污染
D.机动车尾气污染
设计的问题是:你认为造成该市空气污染的最主要的原因是什么?并就此调查了该市100名市民和100位环保部门人士,调查结果如下图所示:

空气污染原因
图一 市民的观点

空气污染原因
图二 环保人士的观点
(1)该市市民认为造成该市空气污染的最主要的原因是___________,环保人士认为造成该市空气污染的最主要原因是___________。
(2)上述调查结果说明该市市民对______造成的空气污染认识不足。该原因造成的大气污染的主要有害成分是___________,空气中该成分含量较高时,在空气中的氧气和水的共同作用下,会形成酸雾,其化学反应方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com