
【题目】下列说法不正确的是
A.复分解反应一定不是氧化还原反应
B.置换反应一定是氧化还原反应
C.有单质参加的化合反应一定是氧化还原反应
D.没有单质生成的分解反应一定不是氧化还原反应
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E的原子序数依次增大,其中E不属于短周期元素,常见单质分子B2中含有3对共用电子对,D的最外层电子数是周期序数的2倍,E单质是一种紫红色金属,甲、乙、丙是上述部分元素组成的二元化合物.且乙、丙分子所含电子总数相同,转化关系如图所示,其中甲是黑色固体,丙是一种常见的无色液体。下列说法不正确的是
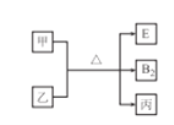
A. 乙分子中共用电子对数目与B2分子相同
B. 单质D与E在加热时可生成1:1型化合物
C. 原子半径:B>C
D. C与D位于同一主族,与B位于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:
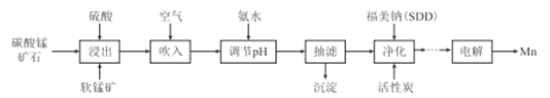
已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(开始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列问题:
(1)FeS2中S元素的化合价为_____价。
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:___
(3)向浸出液中吹入空气的目的是__________(用离子方程式表示)。
(4)调节pH的最佳范围是_______,沉淀的成分是______(填化学式)。
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为__NA。
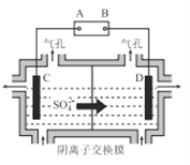
(6)工业上采用如图所示的方法获得金属Mn,B极为____极,若没有阴离子交换膜,Mn2+将在D极发生反应生成MnO2,则电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族化合物H常用作防腐剂,H可利用下列路线合成: 
已知:①A是相对分子质量为92的烃;
②  (﹣R1、﹣R2表示氢原子或烃基);
(﹣R1、﹣R2表示氢原子或烃基);
③ ![]() ;
;
④D的核磁共振氢谱表明其有两种不同化学环境的氢(两种不同位置的氢原子),且峰面积之比为1:1.
回答下列问题:
(1)A的分子式为 .
(2)同时符合下列条件的E的同分异构体共有种. ①分子中含有苯环 ②能发生银镜反应 ③能与FeCl3溶液发生显色反应
(3)检验F中含氧官能团的试剂为 .
(4)H的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行两组电解实验。
实验一:已知固体电解质只有特定离子才能移动。按照下图装置研究α-AgI固体电解质导体是Ag+导电还是I-导电;

实验二:用惰性电极电解硫酸铜和盐酸混合液,对产生的气体进行研究。
关于以上实验,下列说法正确的是
A. 实验一:若α-AgI固体是Ag+导电,则通电一段时间后的晶体密度不均匀
B. 实验一:若α-AgI固体是I-导电,则通电一段时间后的晶体密度仍均匀
C. 实验二:若阳极为纯净气体,阴、阳两极产生的气体体积比可能≥1
D. 实验二:若阳极为混合气体,阴、阳两极产生的气体体积比可能≥1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y均为短周期元素,X原子的最外层有2个电子,Y原子的最外层有7个电子,这两种元素形成化合物的化学式是
A. XY B. XY2 C. X2Y D. X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知A是原子结构最简单的元素;B元素原子最外层上的电子数是其电子层数的2倍;A和C之间可形成A2C和A2C2两种化合物;D在同周期主族元素中原子半径最大,请回答下列问题。
(1)C元素在元素周期表中的位置是____________;C、D两种元素所形成的简单离子,离子半径由大到小的顺序是________________。(用离子符号表示)
(2)写出A2C2的电子式__________。
(3)在恒温下,体积为2 L的恒容容器中加入一定量的B单质和1 mol A2C蒸汽,发生:B(s)+A2C(g) BC(g)+A2(g)。2 min后,容器的压强增加了20%,则2 min内A2C的反应速率为________。一段时间后达到平衡,下列说法正确的是__________。
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2 min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在DCA溶液中可形成一种燃料电池。该电池的负极反应式为:___________。
(5)将0.2 mol D2C2投入到含有0.1 mol FeCl2的水溶液中恰好充分反应,反应的总化学方程式为:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com