
����Ŀ��A��B��C��DΪ������Ԫ�أ��˵��������������A��B��C����Ԫ�ص�ԭ�Ӻ�����Ӳ���֮��Ϊ5����֪A��ԭ�ӽṹ���Ԫ�أ�BԪ��ԭ��������ϵĵ�����������Ӳ�����2����A��C֮����γ�A2C��A2C2���ֻ����D��ͬ��������Ԫ����ԭ�Ӱ뾶�����ش��������⡣
(1)CԪ����Ԫ�����ڱ��е�λ����____________��C��D����Ԫ�����γɵļ����ӣ����Ӱ뾶�ɴ�С��˳����________________��(�����ӷ��ű�ʾ)
(2)д��A2C2�ĵ���ʽ__________��
(3)�ں����£����Ϊ2 L�ĺ��������м���һ������B���ʺ�1 mol A2C������������B(s)��A2C(g) BC(g)��A2(g)��2 min��������ѹǿ������20%����2 min��A2C�ķ�Ӧ����Ϊ________��һ��ʱ���ﵽƽ�⣬����˵����ȷ����__________��
A.����B���ʵ�������Ӧ���ʼӿ�
B.���º���ʱ�ڸ�������ͨ��Ar����Ӧ���ʼӿ�
C.������ܶȲ��ٱ仯�����жϸ÷�Ӧ�ﵽ��ƽ��
D.2 minʱ��A2C��ת����Ϊ80%
E.�����ƽ��Ħ����������ʱ���÷�Ӧ�ﵽƽ��
(4)BC��C2��DCA��Һ�п��γ�һ��ȼ�ϵ�ء��õ�صĸ�����ӦʽΪ��___________��
(5)��0.2 mol D2C2Ͷ�뵽����0.1 mol FeCl2��ˮ��Һ��ǡ�ó�ַ�Ӧ����Ӧ���ܻ�ѧ����ʽΪ��______________________________________________��
���𰸡� �ڶ�����VIA�� O2��>Na�� ![]() 0.05 mol/(L��min) CE CO��4OH����2e��==CO32-��2H2O 8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2��
0.05 mol/(L��min) CE CO��4OH����2e��==CO32-��2H2O 8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2��
��������A��B��C��DΪ������Ԫ��,�˵������������,A��ԭ�ӽṹ���Ԫ��,��AΪ��,���ڵ�һ����,A��B��C����Ԫ�ص�ԭ�Ӻ�����Ӳ���֮��Ϊ5,��B��Cֻ�ܴ��ڵڶ�����,BԪ��ԭ��������ϵĵ�����������Ӳ�����2��,����������Ϊ4,��BΪ̼Ԫ��,A��C֮����γ�A2C��A2C2���ֻ�����,��CΪ��Ԫ��;D��ͬ��������Ԫ����ԭ�Ӱ뾶���,����IA��,ԭ������������,��DΪNa��
(1)�������Ϸ�����CΪ��Ԫ��,��Ԫ�����ڱ��е�λ���ǵڶ����ڵ�VIA��, C��D����Ԫ�����γɵļ����ӷֱ�ΪO2����Na��,���ߵ��Ӳ�ṹ��ͬ,�˵����Խ�����Ӱ뾶ԽС,�����Ӱ뾶�ɴ�С��˳����: O2����Na��,
��ˣ�������ȷ����:�ڶ����ڵ�VIA����O2����Na����
(2)H2O2�ĵ���ʽΪ![]()
��ˣ�������ȷ������![]() ��
��
(3)��ת����ˮ�����ʵ���Ϊamol,��
C(s)��H2O(g) CO(g)��H2(g)
��ʼ(mol) 1 0 0
ת��(mol) a a a
ƽ��(mol) 1-a a a
2min��������ѹǿ������20%����1mol![]() (1+20%)=1+a,��a=0.2,��2min��H2O�ķ�Ӧ����Ϊ
(1+20%)=1+a,��a=0.2,��2min��H2O�ķ�Ӧ����Ϊ![]() =0.05 mol/(L��min)��
=0.05 mol/(L��min)��
A.���ӹ��嵥�ʵ���,����Ӱ�컯ѧ��Ӧ����,��A������
B.���º���ʱ�ڸ�������ͨ��Ar,���ı䷴Ӧ�и������ʵ�Ũ��,�ʻ�ѧ��Ӧ���ʲ���,��B������
C.�淴Ӧ������,����������������,�����������,��������ܶ�����,�ܶȲ��ٱ仯�����жϸ÷�Ӧ�ﵽ��ƽ��,����Cѡ������ȷ����
D.2 minʱ��H2O��ת����Ϊ![]() 100%=20%����D������
100%=20%����D������
E.1molˮ��Ӧ�õ�1mol��1mol����,�������ƽ����Է�������Ϊ15,�ʻ��������ƽ����Է���������С,ƽ����Է�����������˵������ƽ������E��ȷ��
��ˣ�������ȷ������0.05 mol/(L��min)��CE��
(4)COȼ�����ɶ�����̼,������̼��Ӧ����̼���,��������������Ӧ,��ȼ�ϵ�صĸ�����ӦΪ��CO��4OH����2e��==CO32-��2H2O,
��ˣ�������ȷ������CO��4OH����2e��==CO32-��2H2O��
(5) ��0.2 mol D2C2Ͷ�뵽����0.1 mol FeCl2��ˮ��Һ��ǡ�ó�ַ�Ӧ���������Ʒ�Ӧ�õ�0.4molNaOH��0.1molO2��0.1molFeCl2��Ӧ����0.2molNaOH���õ�0.1molFe(OH)2��ʣ��0.2molNaOH��0.1molFe(OH)2ת��Ϊ0.1molFe(OH)3��������Ϊ![]() =0.025mol,��ʣ��0.075molO2,��Ӧ���ܵĻ�ѧ����ʽΪ: 8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2��
=0.025mol,��ʣ��0.075molO2,��Ӧ���ܵĻ�ѧ����ʽΪ: 8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2��
��ˣ�������ȷ������8Na2O2��4FeCl2��10H2O===4Fe(OH)3����8NaOH��8NaCl��3O2����


 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.���ֽⷴӦһ������������ԭ��Ӧ
B.�û���Ӧһ����������ԭ��Ӧ
C.�е��ʲμӵĻ��Ϸ�Ӧһ����������ԭ��Ӧ
D.û�е������ɵķֽⷴӦһ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ�� ![]() +
+ ![]()
![]()
![]() ���Ҫ�ϳɻ�����A����ṹΪ��
���Ҫ�ϳɻ�����A����ṹΪ�� ![]() ����˵������ȷ���ǣ�������
����˵������ȷ���ǣ�������
A.������A��HBr �������ʵ���1��1�ӳ�ʱ�������ֲ�ͬ�IJ���
B.�÷�Ӧ��ԭ���Ǽӳɷ�Ӧ
C.�ϳ�A��ԭ�Ͽ����ǣ���Ȳ��2��3��������1��3������ϩ
D.�ϳ�A��ԭ�Ͽ����ǣ�2����Ȳ��2������1��3������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������¡����ݵ��ܱ������н��������������淴Ӧ��(��)2X(g)![]() Y(g)+Z(s)�� (��)A(s)+2B(g)
Y(g)+Z(s)�� (��)A(s)+2B(g)![]() C(g)+D(g)�����������������ٷ����仯ʱ�����Ա������Ҿ��ﵽƽ��״̬����
C(g)+D(g)�����������������ٷ����仯ʱ�����Ա������Ҿ��ﵽƽ��״̬����
�ٻ�������ܶ�
�ڷ�Ӧ������������İٷֺ���
�۷�Ӧ����������������������������֮�ȵ��ڻ�ѧ������֮��
�ܻ�������ѹǿ
�ݹ�������
�������������ʵ���
A���٢ڢۢܢݢ� B���٢ڢۢ� C���٢ڢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ƽ����³ɹ��Ȼ�����гɹ��л��ŵ���������ǣ� ��
A.����ܽ���ϡ��������ȡ����B.�����Ϸ��ֿ�ű��ҩ������
C.�ɶ����з������ѽ����D.������Ȼ��ˮ�����Բ�����60��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ճ������г��������ӵ�ʳ����������������������������Ҷ��������������������Ʒ������ĵ⡢����������Ӧ����Ϊ�� ��
A.Ԫ��B.����C.����D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(FeC2O4��2H2O)��һ�ֵ���ɫ��ĩ��ij����С����������װ�ü�����������������ȷֽ�IJ��ֲ��
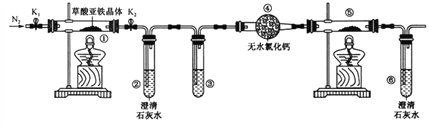
����˵����ȷ����
A. ���ۺ͢��зֱ�ʢ������NaOH��Һ��CuO���ɼ������ɵ�CO
B. ʵ��ʱֻ��Ҫ��װ�â��з�Ӧ��������ͨ��N2
C. �������е���ˮCaCl2������ˮ����ͭ�ɼ���ֽ����ɵ�ˮ����
D. ʵ��������е���ɫ��ĩ��ȫ��ɺ�ɫ�������һ��Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ���������ȷ����
A. Na2O2�ĵ���ʽ��![]()
B. Al3���Ľṹʾ��ͼ��![]()
C. CH3COOCH3�����ƣ��������
D. �õ���ʽ��ʾ�Ȼ�����γɹ��̣�![]() ��
��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���һ����������ͭ��Һ��ʵ��װ������ͼ�ס��������е�ʵ����������ͼ�ң��������ʾ��������ת�Ƶ��ӵ����ʵ������������ʾ�������в������������ ��(��״��)��������˵������ȷ����
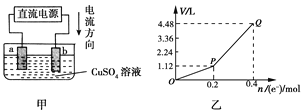
A. �������У�a�缫�������к�ɫ�����������������ݲ���
B. b�缫�Ϸ�����Ӧ�ķ���ʽΪ��4OH����4e��=2H2O��O2��
C. ����O��P�α�ʾO2������仯
D. �ӿ�ʼ��Q��ʱ�ռ����Ļ�������ƽ��Ħ������Ϊ12 g/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com